题目内容
【题目】对于(NH4)2SO4溶液,下列说法正确的是( )
A.溶液中存在电离平衡:(NH4)2SO4?2NH ![]() +SO
+SO ![]()
B.向溶液中滴加少量浓硫酸,c(NH ![]() )与c(SO
)与c(SO ![]() )均增大
)均增大
C.加水稀释,溶液中所有离子的浓度均减小
D.溶液中:c(SO ![]() )=2c(NH
)=2c(NH ![]() )+2c(NH3?H2O)
)+2c(NH3?H2O)
【答案】B
【解析】解:A.硫酸铵是强电解质能完全电离,电离方程式应该用等号连接,即(NH4)2SO4═NH ![]() +SO
+SO ![]() ,故A错误; B.向溶液中滴加少量浓硫酸,电离出氢离子和硫酸根离子,其中氢离子对铵根离子的水解平衡NH
,故A错误; B.向溶液中滴加少量浓硫酸,电离出氢离子和硫酸根离子,其中氢离子对铵根离子的水解平衡NH ![]() +H2ONH3H2O+H+产生抑制作用,所以c(NH
+H2ONH3H2O+H+产生抑制作用,所以c(NH ![]() )、c(SO
)、c(SO ![]() )均增大,故B正确;
)均增大,故B正确;
C.加水稀释对水解平衡NH4++H2ONH3H2O+H+起到促进作用,溶液里c(H+)减小,Kw不变,则c(OH﹣)增大,故C错误;
D.该溶液中的物料守恒:2c(SO ![]() )=c(NH
)=c(NH ![]() )+c(NH3H2O),故D错误,
)+c(NH3H2O),故D错误,
故选B.

【题目】已知某种燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为g,假设广口瓶里生成一种正盐,其质量为g.
(2)生成的水中氢元素的质量为g.
(3)生成的CO2中碳元素的质量为g.
(4)该燃料中碳、氢元素质量比为 .
【题目】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。
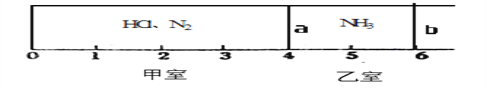
(1)甲室中HCl、N2的质量之比为__________________。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________”处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶液的密度/gcm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________molL-1。
(3)将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等质量混合,所得溶液的物质的量浓度__________0.6c2molL-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)。
