题目内容
【题目】在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是( )
A. 等质量的Na和Mg B. 0.1molZn和0.1molAl
C. 8.4gMgCO3和8.4gNaHCO3 D. 10gCaCO3和10gMgCO3
【答案】C
【解析】A. 2Na+2HCl![]() 2NaCl+H2↑,溶液质量差值与反应消耗Na质量之比为22:23,Mg+2HCl
2NaCl+H2↑,溶液质量差值与反应消耗Na质量之比为22:23,Mg+2HCl![]() MgCl2+H2↑,溶液质量差值与反应消耗Mg质量之比为11:12,22:23≠11:12,所以消耗等质量的Na和Mg,反应后溶液质量不相等,故A天平不能保持平衡;B. Zn+2HCl
MgCl2+H2↑,溶液质量差值与反应消耗Mg质量之比为11:12,22:23≠11:12,所以消耗等质量的Na和Mg,反应后溶液质量不相等,故A天平不能保持平衡;B. Zn+2HCl![]() ZnCl2+H2↑,反应每消耗1mol即65gZn,生成2g氢气,溶液质量增大63g,2Al+6HCl
ZnCl2+H2↑,反应每消耗1mol即65gZn,生成2g氢气,溶液质量增大63g,2Al+6HCl![]() 2AlCl3+3H2↑,反应每消耗1mol即27gAl,生成3g氢气,溶液质量增大24g,所以反应消耗0.1molZn和0.1molAl,反应后溶液质量不相等,故B天平不能保持平衡;C. MgCO3+2HCl
2AlCl3+3H2↑,反应每消耗1mol即27gAl,生成3g氢气,溶液质量增大24g,所以反应消耗0.1molZn和0.1molAl,反应后溶液质量不相等,故B天平不能保持平衡;C. MgCO3+2HCl![]() MgCl2+H2O+CO2↑,NaHCO3+HCl
MgCl2+H2O+CO2↑,NaHCO3+HCl![]() NaCl+H2O+CO2↑,反应消耗8.4gMgCO3和8.4gNaHCO3均生成4.4gCO2,溶液质量相等,故C天平保持平衡;D. MgCO3+2HCl
NaCl+H2O+CO2↑,反应消耗8.4gMgCO3和8.4gNaHCO3均生成4.4gCO2,溶液质量相等,故C天平保持平衡;D. MgCO3+2HCl![]() MgCl2+H2O+CO2↑,CaCO3+2HCl
MgCl2+H2O+CO2↑,CaCO3+2HCl![]() CaCl2+H2O+CO2↑,反应消耗10gCaCO3和10gMgCO3,生成CO2的质量不相等,反应后溶液质量不相等,故D天平不能保持平衡。故选C。
CaCl2+H2O+CO2↑,反应消耗10gCaCO3和10gMgCO3,生成CO2的质量不相等,反应后溶液质量不相等,故D天平不能保持平衡。故选C。

【题目】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。
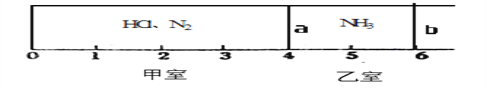
(1)甲室中HCl、N2的质量之比为__________________。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________”处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶液的密度/gcm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________molL-1。
(3)将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等质量混合,所得溶液的物质的量浓度__________0.6c2molL-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)。

