题目内容
【题目】铅蓄电池的总反应式为:PbO2+Pb+2H2SO4 ![]() 2PbSO4+2H2O据此判断下列叙述正确的是( )
2PbSO4+2H2O据此判断下列叙述正确的是( )
A.放电时,H2SO4浓度增加
B.放电时,负极的电极反应式为:Pb+SO42﹣﹣2e﹣═PbSO4
C.在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸
D.在充电时,阴极发生的反应是PbSO4﹣2e﹣+2H2O═PbO2+SO42﹣+4H+
【答案】B
【解析】解:A.根据电池反应式知,放电时消耗硫酸,所以硫酸浓度降低,故A错误;B.蓄电池放电时,负极上铅失电子和硫酸根离子反应生成硫酸铅,电极反应式为:Pb+SO42﹣﹣2e﹣=PbSO4 , 故B正确;
C.由充电的总反应分析,每生成1molPb,则转移2mol电子,同时也生成2mol硫酸,所以电池中每转移1mol电子,理论上生成1mol硫酸,故C错误;
D.充电时,负极与阴极相连,则阴极的电极反应为PbSO4+2e﹣=Pb+SO42﹣ , 故D错误;
故选B.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。
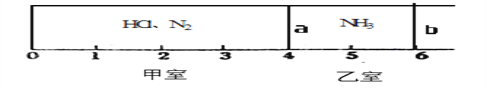
(1)甲室中HCl、N2的质量之比为__________________。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________”处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶液的密度/gcm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________molL-1。
(3)将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等质量混合,所得溶液的物质的量浓度__________0.6c2molL-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)。