题目内容
【题目】甲醇是一种可再生的绿色能源,CO2是一种温室气体,都是重要的化工原料。
(1)已知CO的燃烧热△H为-283kJ·mol-1,CO(g)+2H2(g)![]() CH3OH(l) △H=-129kJ·mol-1,欲求出CH3OH的燃烧热.则需要知道一个反应,该反应的热化学方程式为___。(无需写出△H的具体数值)
CH3OH(l) △H=-129kJ·mol-1,欲求出CH3OH的燃烧热.则需要知道一个反应,该反应的热化学方程式为___。(无需写出△H的具体数值)
(2)向温度不同容积均为1 L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=Q kJ·mol-1,反应过程中维持各容器温度不变,测得t1时刻各密器中H2O的体积分数(H2O)如图所示。
CH3OH(g)+H2O(g) △H=Q kJ·mol-1,反应过程中维持各容器温度不变,测得t1时刻各密器中H2O的体积分数(H2O)如图所示。

①Q___(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是___。
②t2时刻时,容器b中正反应速率__(填“大于”“小于”或“等于”)容器e中正反应速率;
③Td℃时,该反应的平衡常数K=__;
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品。
①NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-):c(CO32-)=2:1,则所得溶液的pH=___[常温下Kl(H2CO3)=4.4×10-7、K2(HCO3-)=5×10-11]。
②在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,将微溶的CaSO4难溶性的CaCO3的理由是___。
(4)用甲醇作为燃料电池的原料,请写出在碱性介质中电池负极反应式____。
【答案】2H2(g)+O2![]() 2H2O(l) △H < a、b 小于 4 10 CaSO4难溶于酸,而CaCO3易溶于酸中 CH3OH-6e-+8OH-=CO32-+7H2O
2H2O(l) △H < a、b 小于 4 10 CaSO4难溶于酸,而CaCO3易溶于酸中 CH3OH-6e-+8OH-=CO32-+7H2O
【解析】
(1)欲求出CH3OH的燃烧热,根据CH3OH燃烧生成二氧化碳和液态水,所以根据盖斯定律还应该有生成二氧化碳和液态水的热化学方程式,又已知CO的燃烧热为-283kJ·mol-1,即CO (g)+![]() O2 (g)CO2(g) △H=-283kJ·mol-1,那还必须有生成液态水的热化学方程式,则需要知道一个H2 (g) 燃烧的热化学方程式,所以该反应的热化学方程式为2H2(g)+O2
O2 (g)CO2(g) △H=-283kJ·mol-1,那还必须有生成液态水的热化学方程式,则需要知道一个H2 (g) 燃烧的热化学方程式,所以该反应的热化学方程式为2H2(g)+O2![]() 2H2O(l) △H;
2H2O(l) △H;
(2)①a、b、c、d、e五个恒容密闭容器,由图像可知对应温度依次升高,则反应速率也依次增大,由于c中水的体积分数最大,表明t1时刻d、e已处于平衡状态,a、b肯定没有达到平衡状态,c可能处于平衡状态,又因为达到平衡后,升高温度水的体积分数反而减小,说明升高温度平衡向逆反应进行,则正反应为放热反应,即△H<0;
②t1时刻时,a、e容器水的体积分数相等,说明a、e容器中反应物浓度相同,又e容器温度大于a,所以容器a中正反应速率小于容器e中正反应速率;
③ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始/mol 3 7 0 0
转化/mol x 3x x x
平衡/mol 3-x 7-3x x x
根据时Td℃,平衡水的体积分数为![]() ,所以
,所以![]() ,解得x=2,则根据K=
,解得x=2,则根据K=![]() =
=![]() =4;
=4;
(3)①某次捕捉后得到的溶液中c(HCO3-):c(CO32-)=2:1,则溶液酸碱性主要由CO32-+H2O![]() HCO3-+OH-,K=
HCO3-+OH-,K=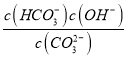 =
=![]() ,所以c(OH-)=
,所以c(OH-)=![]() =
=![]() =10-4,则c(H+)=10-10,pH=-lg c(H+)=10;
=10-4,则c(H+)=10-10,pH=-lg c(H+)=10;
②因为CaSO4难溶于酸难除去,而CaCO3易溶于酸中易除去,所以在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,故答案为CaSO4难溶于酸,而CaCO3易溶于酸中;
(4)用甲醇作为燃料电池的原料,在碱性介质中电池负极甲醇失电子生成碳酸盐,电极反应式为CH3OH-6e-+8OH-=CO32-

【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生反应:![]()
![]() 实验测得有关数据如下表所示:
实验测得有关数据如下表所示:
容器编号 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化/kJ | ||
|
|
| ||
甲 | 2 | 1 | 0 |
|
乙 | 1.8 | 0.9 | 0.2 |
|
丙 | 0 | 0 | 2 |
|
下列判断中正确的是( )
A.![]()
B.若升高温度,反应的热效应不变
C.![]()
D.生成![]() 时放出的热量大于98.5 kJ
时放出的热量大于98.5 kJ
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率