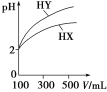
题目内容
【题目】(1)已知碳单质的燃烧热为-393.5 kJmol-1,CO的燃烧热为-283kJmol-1,写出碳不完全燃烧生成CO的热化学方程式______________________________________。
(2)以CO为燃料,可以制成燃料电池。以CO为燃料,熔融碳酸盐为电解质的燃料电池正极通入的气体是_____________,负极的电极反应式____________________________。
(3)CO是汽车尾气之一,严重污染空气,在汽车上安装尾气处理器,发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
现在固定容积为2L的密闭容器中通入NO和CO各2mol发生上述反应,随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
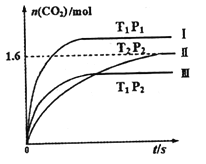
①曲线I、II、III对应反应从开始到平衡时用CO2表示的平均反应速率分别为V(I)、V(II)、V(III),则三者大小关系为______________。
②该反应△H__________0(填“>”、“=”或“<”);曲线II对应平衡常数K=_________;
曲线II对应的反应达平衡后,再通入2molNO和2molCO并保持温度不变,则再达平衡时NO的转化率将_______(填“增大”、“减小”或“不变”)。
③若维持温度为T2压强为P2的条件下,按下列四种方法改变起始物质的用量,达到平衡后,CO2的浓度为0.8 mol·L-1的是______________________________。
A.4mol NO+4 mol CO B.2 mol N2+2 mol CO2
C.1mol NO+1mol CO+1 mol N2+2 mol CO2 D.1mol NO+2mol N2+2 mol CO2
【答案】 2C(s)+ O2(g)= 2CO(g)△H=-221kJmol-1 O2 、CO2 CO-2e- + CO32- = 2CO2 V(I) >V(III) >V(II) < 160 增大 AC
【解析】试题分析:(1)根据碳单质的燃烧热写碳完全燃烧的热化学方程式,根据CO的燃烧热写CO燃烧的热化学方程式,根据盖斯定律写碳不完全燃烧生成CO的热化学方程式。
(2)以CO为燃料,熔融碳酸盐为电解质的燃料电池正极反应是![]() ,负极是CO失电子生成CO2。
,负极是CO失电子生成CO2。
(3)CO是汽车尾气之一,严重污染空气,在汽车上安装尾气处理器,发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
现在固定容积为2L的密闭容器中通入NO和CO各2mol发生上述反应,随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
①根据曲线的拐点时间来确定化学反应速率的大小。
②根据温度对化学平衡的影响知识来回答△H;根据三段式来进行计算曲线II对应平衡常数;据化学平衡移动的影响因素来确定转化率的变化;。
③根据等效平衡原理分析。
解析:(1)碳完全燃烧的热化学方程式①![]() H=-393.5 kJmol-1, CO燃烧的热化学方程式②
H=-393.5 kJmol-1, CO燃烧的热化学方程式②![]() -283kJmol-1 ,根据盖斯定律,①×2-②×2得碳不完全燃烧生成CO的热化学方程式2C(s)+ O2(g)= 2CO(g)△H=-221kJmol-1。
-283kJmol-1 ,根据盖斯定律,①×2-②×2得碳不完全燃烧生成CO的热化学方程式2C(s)+ O2(g)= 2CO(g)△H=-221kJmol-1。
(2)以CO为燃料,熔融碳酸盐为电解质的燃料电池正极反应是![]() ,所以正极通入O2 、CO2;负极是CO失电子生成CO2,电极反应为CO-2e- + CO32- = 2CO2。
,所以正极通入O2 、CO2;负极是CO失电子生成CO2,电极反应为CO-2e- + CO32- = 2CO2。
(3)①根据“先拐先平”速率快,CO2表示的平均反应速率V(I) >V(III) >V(II)。
②根据曲线II、III,可知![]() ,升高温度CO2的含量降低,△H<0;
,升高温度CO2的含量降低,△H<0;

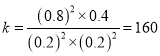
曲线II对应的反应达平衡后,再通入2molNO和2molCO并保持温度不变,相当于加压,再达平衡时NO的转化率将增大;
③维持温度为T2压强为P2的条件下,根据等效平衡原理,为等比等效,故AC正确。