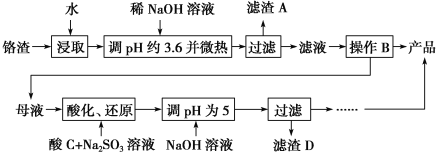
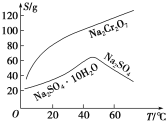
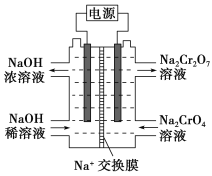
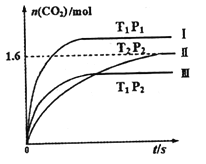
��Ŀ����
����Ŀ��ˮ�Ǽ����ĵ���ʣ��ı��¶Ȼ����ijЩ����ʻ�Ӱ��ˮ�ĵ��롣��ش��������⣺
(1)��ˮ��100 ��ʱ��pH��6�����¶���0.1 mol��L��1��NaOH��Һ��pH��________��
(2)25 ��ʱ����ˮ�м�������̼���ƹ��壬�õ�pHΪ11����Һ����ˮ�����Ҫ���ӷ���ʽΪ_______________________________________����ˮ�������
c(OH��)��________mol��L��1��
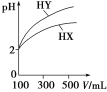
(3)�����Ϊ100 mL��pH��Ϊ2��һԪ��HX��HY����ˮϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ����HX��________(�ǿ�ᡱ�����ᡱ)��������_________________________��
(4)����ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ��������������֪��
��ѧʽ | ����ƽ�ⳣ��(25 ��) |
HCN | K��4.9��10��10 |
CH3COOH | K��1.8��10��5 |
H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��25 ��ʱ����Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ����Һ��pH�ɴ�С��˳��Ϊ______________________(�ѧʽ)��
��25 ��ʱ����0.5 mol��L��1�Ĵ�����Һ���ɴ���������c(H��)Լ����ˮ�������c(H��)��________����
���𰸡�(1)11
(2)CO![]() ��H2O
��H2O![]() HCO
HCO![]() ��OH�� 10��3
��OH�� 10��3
(3)���� ϡ����ͬ������һԪ��HX��pH�仯����HY��С��˵��HX���ڵ���ƽ�⣬��HXΪ����
(4)��Na2CO3>NaCN>CH3COONa ��9��108
��������(1)���������֪��c(OH��)��0.1 mol��L��1�����¶��£�Kw��c(H��)��c(OH��)��10��12����c(H��)��10��11mol��L��1��pH��11��(2)̼���ˮ������ӷ���ʽΪCO![]() ��H2O
��H2O![]() HCO
HCO![]() ��OH����pH��11˵��c(H��)��10��11mol��L��1��c(OH��)��
��OH����pH��11˵��c(H��)��10��11mol��L��1��c(OH��)��![]() mol��L��1��10��3mol��L��1����Һ�е�OH��ȫ������ˮ��������ġ�(4)���������Խ�������Ӧ���ε�ˮ��̶�Խ����Խǿ��pHԽ���ɱ�֪���ԣ�CH3COOH>H2CO3>HCN>HCO
mol��L��1��10��3mol��L��1����Һ�е�OH��ȫ������ˮ��������ġ�(4)���������Խ�������Ӧ���ε�ˮ��̶�Խ����Խǿ��pHԽ���ɱ�֪���ԣ�CH3COOH>H2CO3>HCN>HCO![]() ����pH��Na2CO3>NaCN>CH3COONa�����ɴ���ĵ���ƽ�ⳣ���Ķ����K(CH3COOH)��
����pH��Na2CO3>NaCN>CH3COONa�����ɴ���ĵ���ƽ�ⳣ���Ķ����K(CH3COOH)��![]() ��
��![]() ��1.8��10��5��c(CH3COOH)��0.5 mol��L��1����c(H��)��3��10��3mol��L��1����ˮ�������������Ũ��ԼΪ
��1.8��10��5��c(CH3COOH)��0.5 mol��L��1����c(H��)��3��10��3mol��L��1����ˮ�������������Ũ��ԼΪ![]() mol��L��1�����ɴ���������c(H��)Լ����ˮ�������c(H��)��
mol��L��1�����ɴ���������c(H��)Լ����ˮ�������c(H��)��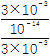 ��9��108����
��9��108����

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�