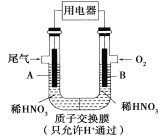
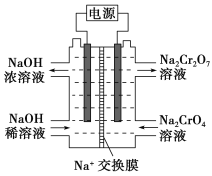
��Ŀ����
����Ŀ��100��ʱ����0.1 mol N2O4����1L�ܱյ���ƿ�У�Ȼ����ƿ����100�� �ĺ��²��У���ƿ�ڵ�������Ϊ����ɫ��
N2O4(g)![]() 2NO2(g)�����н��۲���˵��������Ӧ�ڸ��������Ѿ��ﵽƽ��״̬����
2NO2(g)�����н��۲���˵��������Ӧ�ڸ��������Ѿ��ﵽƽ��״̬����
��N2O4������������NO2����������֮��Ϊ1:2
��NO2����������NO2�����������
����ƿ�������ѹǿ���ٱ仯
����ƿ��������������ٱ仯
��NO2�����ʵ���Ũ�Ȳ��ٸı�
����ƿ���������ɫ���ټ���
����ƿ�������ƽ����Է����������ٱ仯
����ƿ��������ܶȲ��ٱ仯��
A. �ڢۢޢ� B. �٢ܢ� C. ֻ���٢� D. ֻ���ߢ�
���𰸡�B
������������������ж�һ����Ӧ�Ƿ�ﵽƽ��״̬��ʵ�������淴Ӧ������ȣ���־�����������Ƿ���������ﵽ��������������N2O4������������NO2���������ʣ�����ʾ����Ӧ������NO2�������ʣ���ʾ�淴Ӧ��NO2�������ʣ���ʾ����Ӧ�������������ʼ�ղ��䣻����ƿ�������ƽ����Է����������ù�ʽM=m/n���㣬m���䣬nǰ��ͬ����M�DZ仯�ģ�����ﵽ���䣬��Ӧ��ﵽƽ�⣻����ƿ��������ܶ���=m/V,m���䣬����Ϊ1L�ܱյ���ƿ�����ܶ���ʼ����û�б仯��

 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�