题目内容
(13分)下表为元素周期表的一部分,A、B、D、E、G、L、Q为部分元素。其中L的单质在人类的生产和生活中有着十分重要的作用,Q的化合物可以有黑色、红色、蓝色、白色等多种颜色。
(1)请回答下列问题:
①写出G-的结构示意图:________。
②元素L在周期表中的位置:________。
③元素Q的单质为红色,写出单质Q在空气中生锈的化学方程式:_______________。
(2)由A、D、E、G、L五种元素组成的物质[DL(EA)nG6-n]m(其中m、n为正整数,n<5、m<10)广泛应用于日常生活用水和工业污水的处理。某化工厂以工业生产废料(D、L的单质及其氧化物)为原料制取[DL(EA)nG6-n]m,设计的生产流程如下:
①选用的试剂X应为________。
②下列关于[DL(EA)nG6-n]m的说法正确的是________(填序号)。
A.该物质中L元素的化合价为+2
B.该物质在熔融态不导电
C.该物质在强酸和强碱性溶液中均不能稳定存在
D.该物质溶于水能电离出(EA)离子,是一种碱
③写出上述流程的酸性溶液中加入BGE3时,发生反应的离子方程式:_______________。
(1)① ②第四周期第 Ⅶ族 ③2Cu+O2+CO2+H2O===Cu2(OH)2CO3
(2)①过量盐酸 ②C ③6Fe2++ClO+6H+===6Fe3++Cl-+3H2O
解析:(1)考查周期表的结构和元素周期律的应用。G是17号元素氯元素。L是铁元素,Q是铜元素,在空气中被氧气氧化形成铜绿,方程式为
Cu+O2+CO2+H2O===Cu2(OH)2CO3。
(2)A、D、E、G、L五种元素分别是H、Al、O、Cl、Fe。在化合物[AlFe(OH)nCl6-n]m中负电荷数一个是6个,铝和铁的化合价均是+3价。在溶液中该化合物可电离出Fe3+、Al3+、Cl-和OH-,所以只有选项C正确。因为不能引入杂质,所以溶解时用盐酸。混合物溶解时生成亚铁离子,而BGE3是NaClO3具有氧化性,可将Fe2+氧化生成Fe3+,方程式为6Fe2++ClO+6H+===6Fe3++Cl-+3H2O。









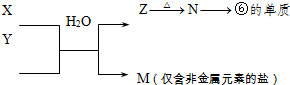
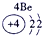
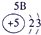
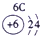
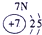
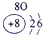
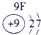
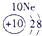
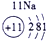





 表示的是
表示的是