题目内容
【题目】将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式__________________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素形成的单质,通常为固体,俗名是________。
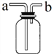
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的固体药品为_________,若用如图所示装置收集E气体,则应从___(填“a”或“b”)通入。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为______,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_____________________、_______________________、_______________________。
(5)取一定量的X晶体分解,若生成F 1mol,则必同时生成____mol___(填物质的化学式)。
【答案】 (1)Al2O3+2OH﹣=2AlO2﹣+H2O(或Al2O3+3H2O+2OH﹣=2[Al(OH)4]﹣) (2)硫黄 (3)NH4Cl和Ca(OH)2 (4)b (5)NH4Al(SO4)2·12H2O (6)生成白色沉淀 (7)生成刺激性气味的气体 (8)白色沉淀又逐渐溶解 (9)3 (10)SO2
【解析】(1)既能溶于强酸又能溶于强碱的常见氧化物A为Al2O3,与强碱溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)由B、D都是酸性氧化物且组成元素相同,B、D分子中除氧外所含另一种元素在两种化合物中的质量分数分别为50%和40%,可知B、D分别为SO3和SO2,B、D分子中除氧元素外所含另一种元素形成的单质为硫黄,故答案为:硫黄;
(3)E能使湿润的红色石蕊试纸变蓝,则E为NH3,实验室制备氨气的方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,由于氨气的密度比空气小,应用向下排空气法收集,故应从b管通入气体收集,故答案为:NH4Cl和Ca(OH)2;b;
CaCl2+2NH3↑+2H2O,由于氨气的密度比空气小,应用向下排空气法收集,故应从b管通入气体收集,故答案为:NH4Cl和Ca(OH)2;b;
(4)根据以上分析可知,X中含有铝离子、铵根离子、硫酸根离子,再结合X的组成类似于明矾,可知其化学式为:NH4Al(SO4)212H2O;NH4Al(SO4)212H2O的溶液中含有铵根离子和铝离子,加入氢氧化钠溶液后,铝离子先与氢氧根离子反应生成氢氧化铝白色沉淀,铝离子反应完全后铵根离子与氢氧根离子反应生成氨气,最后白色沉淀氢氧化铝会逐渐溶解,故答案为:NH4Al(SO4)212H2O;生成白色沉淀;生成刺激性气味的气体;白色沉淀又逐渐溶解;
(5)生成1molN2转移6 mol电子,根据电子守恒守恒,生成SO2的物质的量为: ![]() =3mol,故答案为:3;SO2。
=3mol,故答案为:3;SO2。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已 知 | 类 推 | |
A | 将铁粉投入稀硫酸中 Fe+H2SO4(稀)= FeSO4+H2↑ | 将铁粉投入稀硝酸中 Fe+2HNO3(稀)= Fe(NO3)2+H2↑ |
B |
|
|
C | 将乙烯通入溴水中 CH2=CH2+Br2→CH2BrCH2Br | 将丙烯通入溴水中 CH3CH=CH2+Br2→CH3CHBrCH2Br |
D | 乙烯在适当条件下制聚乙烯 nCH2=CH2 | 丙烯在适当条件下制聚丙烯 nCH3CH=CH2 |
A. A B. B C. C D. D

