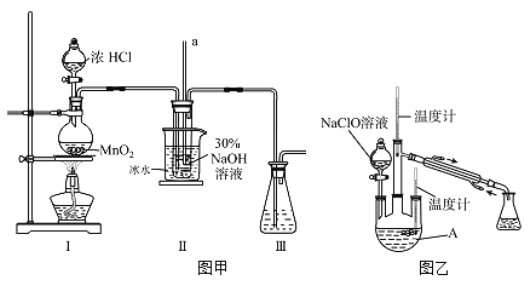
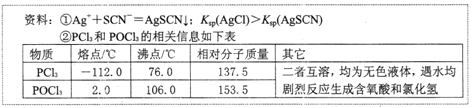
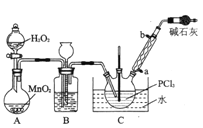
题目内容
【题目】下列现象与氧化还原反应无关的是
A.铝在空气中生成致密的氧化膜
B.雷雨肥庄稼
C.将铁片放入CuSO4溶液中,铁片表面有红色物质出现
D.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成
【答案】D
【解析】
试题分析:A.铝在空气中生成致密的氧化膜是铝和氧气发生的氧化还原反应,A错误;B.雷雨肥庄稼发生的氮气和氧气反应生成NO,NO又被氧化为NO2等,B错误;C.将铁片放入CuSO4溶液中,铁片表面有红色物质出现 ,发生铁置换出铜,属于氧化还原反应,C错误;D.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成,发生的是复分解反应,不是氧化还原反应,D正确,答案选D。

【题目】电化学及溶解沉淀的相关问题
(1)由下列物质冶炼相应金属时,采用电解法的是________(填字母,下同)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的
是_________。
a.电能全部转化为化学能 b.粗铜接电源正极、发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个 f. SO42-的物质的量浓度不变(不考虑溶液体积变化)
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为:______________。
(4)高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为____________。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为____________。
(5) 为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2mL0.005mol·L-1AgNO3溶液中加入2mL0.005 mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1 mol·L-1滴2Fe(OH3)3溶液。 | 溶液变为红色 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1AgNO3溶液 | 现象a_____________, 溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1KI溶液 | 出现黄色沉淀。 |
已知:. AgSCN是白色沉淀。
Ⅱ. 相同温度下,Kap(AgI)=8.3×10-17,Kap(AgSCN)=1.0×10-12。
①步骤3中现象a是__________________。
②用沉淀溶解平衡原理解释步骤4的实验现象_________________。
③向50mL0.005 mol·L-1AgNO3溶液中加入150mL0.005 mol·L-1的KSCN溶液,混合后溶液中Ag+的浓度约为___________mol·L-1。(忽略溶液体积变化)