题目内容
【题目】HBr是一种重要的工业原料,可以用来生产医用药品,合成染料或香料,用作石油化工的催化剂等。如图是工业制备HBr的一种生产流程:

(1)气体a是燃煤工业的烟道气和工业生产硫酸的尾气的成分,结合框图信息可判断气体a的分子式为___。混合物①中加的水为___(填“冰水”或“热水”),原因是___。
(2)试剂b为含氯的盐,b为___(用化学式表示),混合②的目的是___。第二次蒸馏后的“含c的溶液”中c为___。
(3)生产流程中操作A的名称___,实验室中蒸馏操作是在___中进行的。(填玻璃仪器名称)
(4)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲、乙两同学设计了实验加以探究:①甲同学假设工业氢溴酸呈淡黄色是因为含有Fe3+,则用于证明该假设所用的试剂为___(填化学式),若假设成立可观察到的现象为___。
②乙同学假设工业氢溴酸呈淡黄色是因为其中含有杂质___,用于证明该假设成立的方法为___(简单写出实验步骤)。
【答案】SO2 冰水 防止Br2和HBr挥发 BaCl2 除去氢溴酸中杂质Br2,除去反应后的![]() NaCl 过滤 蒸馏烧瓶 KSCN溶液 向溶液中加入少量KSCN溶液,溶液呈红色 溴单质 取少量溶液于试管中,向试管中加入少量苯,振荡摇匀后静置,若溶液上层为橙红色,则说明溶液中含有溴单质
NaCl 过滤 蒸馏烧瓶 KSCN溶液 向溶液中加入少量KSCN溶液,溶液呈红色 溴单质 取少量溶液于试管中,向试管中加入少量苯,振荡摇匀后静置,若溶液上层为橙红色,则说明溶液中含有溴单质
【解析】
(1)由流程图可知,气体a中含有硫元素,且气体a是燃煤工业的烟道气和工业生产硫酸的尾气的成分,因此a为SO2;Br2具有良好的挥发性,且该反应为放热反应,因此所加的水为冰水,
故答案为:SO2;冰水;防止Br2和HBr挥发;
(2)由过滤后滤渣为BaSO4可知试剂b为钡盐,结合b为“含氯的盐”可知其为氯化钡;氢溴酸粗品中含有少量溴单质,故混合②的目的是利用Na2SO3除去Br2,其反应为:Br2+Na2SO3+H2O= Na2SO4+2HBr,反应会生成![]() ,利用氯化钡除去,其反应为:BaCl2+Na2SO4=BaSO4↓+2NaCl,由此可知c为氯化钠,
,利用氯化钡除去,其反应为:BaCl2+Na2SO4=BaSO4↓+2NaCl,由此可知c为氯化钠,
故答案为:BaCl2;除去氢溴酸中杂质Br2,除去反应后的![]() ;NaCl;
;NaCl;
(3)操作A的目的是分离固体和液体,因此操作A为过滤;蒸馏试验中蒸馏操作是在蒸馏烧瓶中进行,
故答案为:过滤;蒸馏烧瓶;
(4)①.检验Fe3+常用KSCN溶液,Fe3+遇KSCN溶液变红;
故答案为:KSCN溶液;向溶液中加入少量KSCN溶液,溶液呈红色;
②.氢溴酸中含有少量的溴单质也会呈淡淡的黄色,若要验证其中含有溴单质,可取少量溶液于试管中,向试管中加入少量苯,振荡摇匀后静置,若溶液上层为橙红色,则说明溶液中含有溴单质,
故答案为:溴单质;取少量溶液于试管中,向试管中加入少量苯,振荡摇匀后静置,若溶液上层为橙红色,则说明溶液中含有溴单质。

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
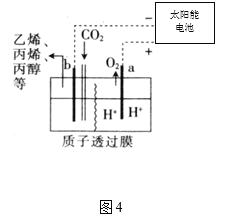
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)