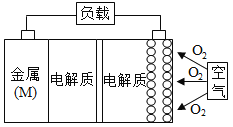
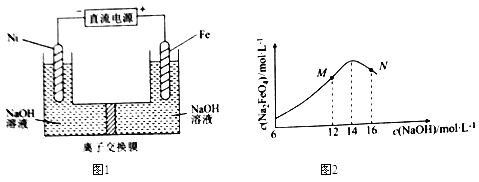
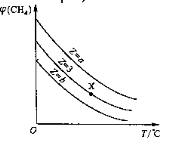
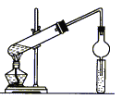
题目内容
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______________。
(2)用于微电子器件生产的锡粉纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________;此锡粉样品中锡的质量分数_____________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤Ⅰ加入Sn粉的作用: __________________及调节溶液pH。
②步骤Ⅱ、步骤Ⅴ的操作名称为________________,写出该过程用到的一种玻璃仪器的名称:_______________。
③步骤Ⅲ生成SnO的离子方程式:__________________。
④步骤Ⅴ操作依次为 _____________、____________、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为__________________。
【答案】(1)50(2)Sn2++2Fe3+=2Fe2++Sn4+;60%
(3)①防止Sn2+被氧化为Sn4+②过滤;漏斗、玻璃棒、烧杯中的任一种
③Sn2++2HCO3-=SnO↓+2CO2↑+H2O④蒸发(或加热)浓缩、冷却(或降温)结晶
(4)SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl
【解析】试题分析:(1)元素锡是第IVA的元素,由于比同主族碳的周期数大3,所以锡的原子序数为6+8+18+18=50;
(2)步骤②中加入Fe2(SO4)3的作用是将Sn2+全部氧化为Sn4+;根据氧化还原反应中电子转移数目相等可得关系式:3Sn~3Fe2(SO4)3~K2Cr2O7,n(K2Cr2O7)=0.1000 mol/L×0.02L=2×10-3mol,则n(Sn)=2×10-3mol×3=6×10-3mol,所以此锡粉样品中锡的质量分数是[(6×10-3mol×119g/mol) ÷1.19 g] ×100%=60%;
(3)①步骤ⅠSn与HCl反应产生SnCl2,SnCl2容易被空气中的氧气氧化为Sn4+,加入Sn粉的作用是防止Sn2+被氧化为Sn4+,同时可以调节溶液pH。
②在步骤Ⅱ过滤用到的玻璃仪器有烧杯、漏斗、玻璃棒;
③步骤Ⅲ中向含有Sn2+的溶液中加入HCO3-,发生反应生成SnO,该反应的离子方程式是Sn2++ 2HCO3-=SnO↓+2CO2↑+ H2O;
④SnO与硫酸反应产生SnSO4,从溶液中分离得到该物质的晶体的操作步骤依次为蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥;
(4)SnCl4是强酸弱碱盐,遇水容易发生水解反应产生Sn(OH)4和HCl,HCl和氨发生反应沉淀NH4Cl,产生白烟,因此可制作烟幕弹,其反应的化学方程式为SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl。