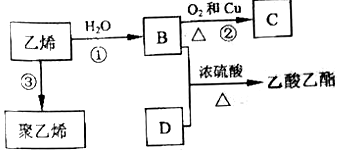
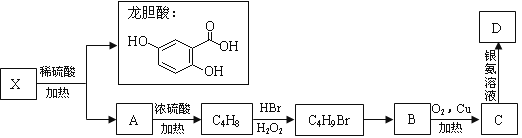
ћвƒњƒЏ»Ё
°Њћвƒњ°њµзљвЈ®÷∆»°”–єгЈЇ”√ЌЊµƒNa2FeO4£ђЌђ ±їсµ√«в∆ш°£є§„ч‘≠јн»зЌЉ1Ћщ Њ£ђc( Na2FeO4)Ћж≥х Љc(NaOH)µƒ±дїѓ»зЌЉ2°£
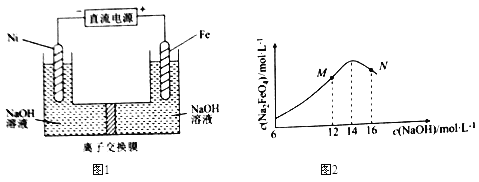
“—÷™£ЇFeO42-ќ™„ѕЇм…Ђ£їNa2FeO4÷ї‘Џ«њЉо–‘ћхЉюѕ¬ќ»ґ®£ђ“„±їH2їє‘≠£ї»№“Ї÷–OH-≈®ґ»єэЄя£ђћъµзЉЂ«шїб≤ъ…ъЇмЇ÷…Ђќп÷ °£ѕ¬Ѕ–ЋµЈ®інќуµƒ «£® £©
A£Ѓ÷∆±ЄNa2FeO4µƒµзЉЂЈі”¶ќ™Fe-6e-+8OH-=FeO42-+4H2O
B£Ѓµзљвєэ≥ћ÷–£ђ–лљЂ“хЉЂ≤ъ…ъµƒ∆шћеЉ∞ ±≈≈≥ц
C£ЃMNЅљµг÷–c(Na2FeO4)µЌ”Џ„оЄя÷µµƒ‘≠“т≤їЌђ£ђ‘ЏMµгїб”–Fe(OH)3…ъ≥…
D£ЃЌЉ1÷–µƒјл„”љїїїƒ§ќ™“хјл„”љїїїƒ§£ђµзљвєэ≥ћ÷–£ђ“хЉЂ«шЄљљьpHїб‘ціу
°Њір∞Є°њC
°Њљвќц°њ
‘ћвЈ÷ќц£ЇA°ҐЄщЊЁћв“вƒшµзЉЂ”–∆ш≈Ё≤ъ…ъ ««вјл„”Ј≈µз…ъ≥…«в∆ш£ђћъµзЉЂЈҐ…ъ—хїѓЈі”¶£ђµзЉЂЈі”¶ љќ™Fe-6e-+8OH-=FeO42-+4H2O£ђA’э»Ј£їB°Ґ«в∆шЊя”–їє‘≠–‘£ђЄщЊЁћв“вNa2FeO4÷ї‘Џ«њЉо–‘ћхЉюѕ¬ќ»ґ®£ђ“„±їH2їє‘≠°£µзљвєэ≥ћ÷–£ђ–лљЂ“хЉЂ≤ъ…ъµƒ∆шћеЉ∞ ±≈≈≥ц£ђЈј÷єNa2FeO4”лH2Јі”¶ є≤ъ¬ љµµЌ£ђB’э»Ј£їC°ҐЄщЊЁћв“вNa2FeO4÷ї‘Џ«њЉо–‘ћхЉюѕ¬ќ»ґ®£ђ‘ЏMµг£ђc(OH-)µЌ£ђNa2FeO4ќ»ґ®–‘≤о£ђ«“Јі”¶¬э£ђ‘ЏNµг£Їc(OH-)єэЄя£ђћъµзЉЂ…ѕ”–«в—хїѓћъ…ъ≥…£ђ єNa2FeO4≤ъ¬ љµµЌ£ђCінќу£їD°Ґ—фЉЂ–и“™ѕыЇƒ«в—хЄщ£ђ“тіЋЌЉ1÷–µƒјл„”љїїїƒ§ќ™“хјл„”љїїїƒ§£ђµзљвєэ≥ћ÷–£ђ«вјл„”‘Џ“хЉЂ«шЈ≈µз£ђ∆∆їµЋЃµƒµзјл∆љЇв£ђЋщ“‘“хЉЂ«шЄљљьpHїб‘ціу£ђD’э»Ј£ђір∞Є—°C°£

°Њћвƒњ°њ∆яЋЃЅтЋб√Њ£®MgSO47H2O£©‘Џ”°»Њ°Ґ‘м÷љЇЌ“љ“©µ»є§“µ…ѕґЉ”–єгЈЇµƒ”¶”√£ђјы”√їѓє§≥І…ъ≤ъ≈р…∞µƒЈѕ‘ь©Б≈р√Њƒањ…÷∆»°∆яЋЃЅтЋб√Њ°£≈р√Њƒаµƒ÷ч“™≥…Ј÷ «MgCO3£ђїєЇђ”–∆дЋы‘”÷ £®MgO°ҐSiO2°ҐFe2O3°ҐFeO°ҐCaO°ҐAl2O3°ҐMnOµ»£©°£
±н1 ≤њЈ÷—фјл„”“‘«в—хїѓќп–ќ љЌк»Ђ≥Ѕµн ±»№“ЇµƒpH
≥Ѕµнќп | Al£®OH£©3 | Fe£®OH£©3 | Fe£®OH£©2 | Mn£®OH£©2 | Mg£®OH£©2 | ||||||
pH÷µ | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 | ||||||
±н2 Ѕљ÷÷—ќµƒ»№љвґ»£®µ•ќїќ™g/100gЋЃ£©
ќ¬ґ»/°ж | 10 | 30 | 40 | 50 | 60 | ||||||||||||
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 | ||||||||||||
MgSO47H2O | 30.9 | 35.5 | 40.8 | 45.6 | / | ||||||||||||
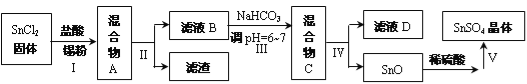
≈р√Њƒа÷∆»°∆яЋЃЅтЋб√Њµƒє§“’Ѕч≥ћ»зѕ¬£Ї
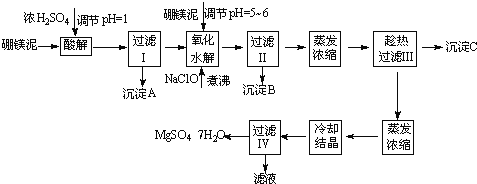
ЄщЊЁ“‘…ѕЅч≥ћЌЉ≤Ґ≤ќњЉ±нЄсpH эЊЁЇЌ»№љвґ» эЊЁ£ђ ‘їЎірѕ¬Ѕ–ќ ћв£Ї
£®1£©єэ¬ЋIµƒ¬Ћ“Ї÷–Љ”»л≈р√Њƒа£ђµчљЏ»№“ЇµƒpH=5°Ђ6£ђ‘ўЉ”»лNaClO»№“ЇЉ”»»÷уЈ–£ђљЂ»№“Ї÷–µƒMn2+—хїѓ≥…MnO2£ђЈі”¶µƒјл„”Јі”¶Јљ≥ћ љќ™ £ЃЉ”»»÷уЈ–µƒ÷ч“™ƒњµƒ « °£
£®2£©≥ЅµнB÷–≥эMnO2°ҐSiO2ЌвїєЇђ”– £®ћоїѓ—І љ£©µ»ќп÷ °£
£®3£©Љм—йєэ¬ЋҐтЇуµƒ¬Ћ“Ї÷– «ЈсЇђ”–Fe3+µƒ µ—йЈљЈ® « °£
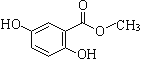
£®4£©≥ЅµнCµƒїѓ—І љ « £Ѓєэ¬ЋҐу–и≥√»»єэ¬Ћµƒјн”… « °£
°Њћвƒњ°њƒ≥–°„йјы”√H2C2O4»№“ЇЇЌЋб–‘KMnO4»№“ЇЈі”¶јіћљЊњ°∞ЌвљзћхЉюґ‘їѓ—ІЈі”¶Ћў¬ µƒ”∞ѕм°±°£ µ—й ±£ђѕ»Ј÷±рЅњ»°Ѕљ÷÷»№“Ї£ђ»їЇуµє»л ‘є№÷–—ЄЋў’сµіїмЇѕЊщ‘»£ђњ™ ЉЉ∆ ±£ђЌ®єэ≤вґ®Ќ …ЂЋщ–и ±Љдјі≈–ґѕЈі”¶µƒњм¬э°£Є√–°„й…иЉ∆ЅЋ»зѕ¬Јљ∞Є°£
±аЇ≈ | H2C2O4»№“Ї | Ћб–‘KMnO4»№“Ї | |||
≈®ґ»/mol°§L£≠1 | ћеїэ/mL | ≈®ґ»/mol°§L£≠1 | ћеїэ/mL | ќ¬ґ»°ж | |
Ґў | 0.10 | 2.0 | 0.010 | 4.0 | 20 |
ҐЏ | 0.20 | 2.0 | 0.010 | 4.0 | 20 |
Ґџ | 0.20 | 2.0 | 0.010 | 4.0 | 40 |
£®1£©–і≥цЄ√Јі”¶µƒїѓ—ІЈљ≥ћ љ °£
£®2£©ћљЊњќ¬ґ»ґ‘їѓ—ІЈі”¶Ћў¬ ”∞ѕмµƒ µ—й±аЇ≈ «________(ћо±аЇ≈£ђѕ¬Ќђ)£ђњ…ћљЊњЈі”¶ќп≈®ґ»ґ‘їѓ—ІЈі”¶Ћў¬ ”∞ѕмµƒ µ—й±аЇ≈ «____________°£
£®3£© µ—饢≤вµ√KMnO4»№“ЇµƒЌ …Ђ ±Љдќ™40s£ђЇц¬‘їмЇѕ«∞Їу»№“ЇћеїэµƒќҐ–°±дїѓ£ђ’вґќ ±ЉдƒЏ∆љЊщЈі”¶Ћў¬ v(H2C2O4)£љ_____________mol°§L£≠1°§min£≠1°£
£®4£© »ф±£≥÷∆дЋыћхЉю≤ї±д£ђѕ¬ЌЉЅљћх«ъѕяЈ÷±р±н Њ20°жЇЌ40°ж ±c(MnO)°ЂЈі”¶ ±Љдtµƒ±дїѓ«ъѕя°£40°ж ±c(MnO)°Ђtµƒ±дїѓ«ъѕяќ™ °££®ћо–іAїтB£©