��Ŀ����
����Ŀ����̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ����������������ϴ�ӡ���֯��ҽҩ������������ҵ�ϳ��Թ�̼���Ʋ�Ʒ�л�����������[O]%= ![]() ��100�������������ӣ�13%����Ϊ�ŵ�Ʒ��һ���Ʊ���̼���ƵĹ���������ͼ1��
��100�������������ӣ�13%����Ϊ�ŵ�Ʒ��һ���Ʊ���̼���ƵĹ���������ͼ1�� 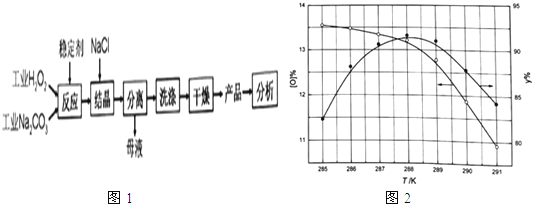
�ش��������⣺
��1����̼���������ֽ⣬д����Ӧ�Ļ�ѧ����ʽ ��
��2���ȶ�������Ӧ�¶ȵ����ضԲ�Ʒ�����кܴ�Ӱ�죮
�������Լ��У������������ȶ���������������ĸ����a��MnO2b��KI c��Na2SiO3d��FeCl3
�ڷ�Ӧ�¶ȶԲ�Ʒ���ʣ�y%����������������Ӱ����ͼ1��ʾ��Ҫʹ��Ʒ�ﵽ�ŵ�Ʒ�Ҳ��ʳ���90%���ʵķ�Ӧ�¶ȷ�Χ�� ��
�ۡ��ᾧ��ʱ����NaCl��Ŀ���� �� ������ԭ���� ��
��3����ĸҺ���п�ѭ�����õ���Ҫ������ ��
��4����Ʒ�л����������IJⶨ����������0.1600g��Ʒ����250mL��ƿ����100mL 0.5molL��1�����ܽ���ȫ��������0.02000molL��1������ر���Һ�ζ�������Һ��dz��ɫ�Ұ�����ڲ���ɫ��Ϊ�յ㣬ƽ�����Σ�����KMnO4��Һ��ƽ�����Ϊ26.56mLo���⣬�ڲ�����Ʒ������°����������̽��пհ�ʵ�飬����KMn04��Һ��ƽ�����Ϊ2.24mL��
�ٹ�̼���������ᷴӦ������������ƺ�ˮ�⣬���� ��
�ڲⶨʱ�����ù�ҵ����������ᣬ�����Բⶨ�����Ӱ�켰��ԭ�� ��
�۸���Ʒ�Ļ���������Ϊ%����������Ʒ����ǡ����ǡ���
���𰸡�
��1��2��Na2CO3?3H2O2 �� ![]() 4Na2CO3+3O2��+6H2O
4Na2CO3+3O2��+6H2O
��2��c��286.8��288.5K����߲���������������Ũ�ȣ��ٽ���̼��������
��3��NaCl
��4��H2O2��CO2��ƫ�ͣ���ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣻12.16������
����������1����̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ�������������ȷֽ�����̼���ơ�������ˮ����ӦΪ��2��Na2CO33H2O2 �� ![]() 4Na2CO3+3O2��+6H2O�����Դ��ǣ�2��Na2CO33H2O2 ��
4Na2CO3+3O2��+6H2O�����Դ��ǣ�2��Na2CO33H2O2 �� ![]() 4Na2CO3+3O2��+6H2O����2���ٹ�̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ��������������̼���ƺ�����������ʣ����������ֽ⣬MnO2��FeCl3Ϊ����������Բ���ѡ����������������ӷ���������ԭ��Ӧ��2I��+H2O2+2H+=I2+2H2O������Ҳ����ѡ����̼����������Ʋ���Ӧ�������������ȶ���������Cѡ����ϣ����Դ��ǣ�c���ڸ���ͼ��������¶�Ϊ286.8��288.5K����Ʒ�ﵽ�ŵ�Ʒ�Ҳ��ʳ���90%������288.5K�������ٷֺ����Ͳ��ʾ����ͣ�������ѷ�Ӧ�¶ȷ�ΧΪ286.8��288.5K�����Դ��ǣ�286.8��288.5K���۽ᾧ�����м����Ȼ��ơ����裬����������Ũ�ȣ��ܽ���̼���Ƶ��ܽ�ȣ������ڹ�̼�������������Դ��ǣ���߲���������������Ũ�ȣ��ٽ���̼������������3���ᾧ�����м����Ȼ��ƴٽ���̼������������ĸҺ������ҪΪ�Ȼ�����Һ��NaCl��Һ���ǽᾧ�����дٽ���̼����������ԭ�ϣ���ѭ�����õ�������NaCl�����Դ��ǣ�NaCl����4���ٹ�̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ������������̼���������ᷴӦ��Ϊ̼���ơ�������������ᷴӦ�����Բ���Ϊ�����ơ��������⡢������̼��ˮ�����Դ��ǣ�H2O2��CO2����Fe3+Ϊ��������ֽ�Ĵ�������ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣬�ⶨʱ�����ù�ҵ����������ᣬ�����Բⶨ���ƫ�ͣ����Դ��ǣ�ƫ�ͣ���ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣻�۳���0.1600g��Ʒ����250mL��ƿ����100mL 0.5molL��1�����ܽ���ȫ��������0.02000molL��1������ر���Һ�ζ�����Ӧ��MnO4������������H2O2�ǻ�ԭ��������������O2������Ԫ�ػ��ϼ۱仯����Ԫ�ػ��ϼ۴�+7�۱仯Ϊ+2�ۣ����������е���Ԫ�ػ��ϼ۴ө�1�۱仯Ϊ0�ۣ����ݵ����غ���ƽд�����ӷ���ʽΪ��2MnO4��+5H2O2+6H+=2Mn2++8H2O+5O2���εζ�ƽ������KMnO4��Һ26.56mL�����ݷ�Ӧ2MnO4��+5H2O2+6H+=2Mn2++8H2O+5O2��
4Na2CO3+3O2��+6H2O����2���ٹ�̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ��������������̼���ƺ�����������ʣ����������ֽ⣬MnO2��FeCl3Ϊ����������Բ���ѡ����������������ӷ���������ԭ��Ӧ��2I��+H2O2+2H+=I2+2H2O������Ҳ����ѡ����̼����������Ʋ���Ӧ�������������ȶ���������Cѡ����ϣ����Դ��ǣ�c���ڸ���ͼ��������¶�Ϊ286.8��288.5K����Ʒ�ﵽ�ŵ�Ʒ�Ҳ��ʳ���90%������288.5K�������ٷֺ����Ͳ��ʾ����ͣ�������ѷ�Ӧ�¶ȷ�ΧΪ286.8��288.5K�����Դ��ǣ�286.8��288.5K���۽ᾧ�����м����Ȼ��ơ����裬����������Ũ�ȣ��ܽ���̼���Ƶ��ܽ�ȣ������ڹ�̼�������������Դ��ǣ���߲���������������Ũ�ȣ��ٽ���̼������������3���ᾧ�����м����Ȼ��ƴٽ���̼������������ĸҺ������ҪΪ�Ȼ�����Һ��NaCl��Һ���ǽᾧ�����дٽ���̼����������ԭ�ϣ���ѭ�����õ�������NaCl�����Դ��ǣ�NaCl����4���ٹ�̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ������������̼���������ᷴӦ��Ϊ̼���ơ�������������ᷴӦ�����Բ���Ϊ�����ơ��������⡢������̼��ˮ�����Դ��ǣ�H2O2��CO2����Fe3+Ϊ��������ֽ�Ĵ�������ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣬�ⶨʱ�����ù�ҵ����������ᣬ�����Բⶨ���ƫ�ͣ����Դ��ǣ�ƫ�ͣ���ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣻�۳���0.1600g��Ʒ����250mL��ƿ����100mL 0.5molL��1�����ܽ���ȫ��������0.02000molL��1������ر���Һ�ζ�����Ӧ��MnO4������������H2O2�ǻ�ԭ��������������O2������Ԫ�ػ��ϼ۱仯����Ԫ�ػ��ϼ۴�+7�۱仯Ϊ+2�ۣ����������е���Ԫ�ػ��ϼ۴ө�1�۱仯Ϊ0�ۣ����ݵ����غ���ƽд�����ӷ���ʽΪ��2MnO4��+5H2O2+6H+=2Mn2++8H2O+5O2���εζ�ƽ������KMnO4��Һ26.56mL�����ݷ�Ӧ2MnO4��+5H2O2+6H+=2Mn2++8H2O+5O2��
2MnO4������������5H2O2��
2 5
��0.2526��0.0224��L��0.02mol/L 0.01216mol
��̼���Ʋ�Ʒ�л�����������[O]%= ![]() ��100%=
��100%= ![]() =12.16%��13%����Ϊ�ŵ�Ʒ���ò�Ʒ���ǣ����Դ��ǣ�12.16�����ǣ�
=12.16%��13%����Ϊ�ŵ�Ʒ���ò�Ʒ���ǣ����Դ��ǣ�12.16�����ǣ�

 53���ò�ϵ�д�
53���ò�ϵ�д�



