题目内容
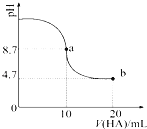
【题目】甲醛在医药、染料、香料等行业中都有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛,试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是?
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的是?
(3)实验过程中,可循环使用的物质有?
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是 , 其原理是
【答案】
(1)
使反应物充分接触,加快反应速率
(2)
降低MnSO4的溶解度
(3)
稀硫酸、甲苯
(4)蒸馏;利用甲苯和苯甲醛的沸点差异使二者分离
【解析】(1)固体Mn2O3与液态的甲苯反应,接触面积小,反应速率慢,搅拌可以使Mn2O3和甲苯充分接触,加快反应速率。(2)从流程图可以看出,反应后的混合物中含有硫酸锰、苯甲醛等。“结晶过滤”可得晶体硫酸锰,将混合物降温是为了降低硫酸锰的溶解度,使其从溶液中结晶析出。(3)由流程图中箭头的指向可以直接看出参与循环的物质是稀硫酸和甲苯。(4)由制备原理可知,甲苯和苯甲醛是相互溶解的有机物,所以油层含有的物质为苯甲醛和未被氧化的甲苯,要使它们分离,只能用蒸馏的方法。
【考点精析】认真审题,首先需要了解蒸馏与分馏(蒸馏是将液态物质加热到沸腾变为蒸气,又将蒸气冷却为液体这两个过程联合操作.用这一操作可分离、除杂、提纯物质;分馏和蒸馏一样,也是利用混合物中各物质的沸点不同,严格控制温度,进行分离或提纯物质的操作,是多次的蒸馏).

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目