题目内容
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.
请回答下列问题:
(1)该“84消毒液”的物质的量浓度为molL﹣1 .
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(3)“84消毒液”可用氯气和氢氧化钠溶液反应制得,写出该反应的化学方程式: .
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数37.25%的消毒液.
需要称量NaClO固体的质量为g.
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是(填选项字母).
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.
【答案】
(1)6
(2)0.06
(3)Cl2+2NaOH═NaCl+NaClO+H2O
(4)223.5
(5)A,D
【解析】解:(1)c(NaClO)= ![]() =
= ![]() =6molL﹣1,所以答案是:6;(2)稀释后c(NaClO)=
=6molL﹣1,所以答案是:6;(2)稀释后c(NaClO)= ![]() ×6molL﹣1=0.06molL﹣1,c(Na+)=c(NaClO)=0.06molL﹣1,所以答案是:0.06;(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,所以答案是:Cl2+2NaOH═NaCl+NaClO+H2O;(4)欲用NaClO固体配制480mL含NaClO质量分数37.25%的消毒液即选用500ml容量瓶,又由(1)该溶液浓度为6molL﹣1,所以需要称量NaClO固体的质量为6×0.5×74.5=223.5g,所以答案是:223.5g;(5)A.定容时仰视容量瓶刻度线,导致溶液体积偏大,浓度偏小;
×6molL﹣1=0.06molL﹣1,c(Na+)=c(NaClO)=0.06molL﹣1,所以答案是:0.06;(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,所以答案是:Cl2+2NaOH═NaCl+NaClO+H2O;(4)欲用NaClO固体配制480mL含NaClO质量分数37.25%的消毒液即选用500ml容量瓶,又由(1)该溶液浓度为6molL﹣1,所以需要称量NaClO固体的质量为6×0.5×74.5=223.5g,所以答案是:223.5g;(5)A.定容时仰视容量瓶刻度线,导致溶液体积偏大,浓度偏小;
B.容量瓶在使用前未干燥,里面有少量蒸馏水,无影响;
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净,导致n偏大,则浓度偏大;
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线溶液体积偏大,浓度偏小;
故选:AD.

 阅读快车系列答案
阅读快车系列答案【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为 .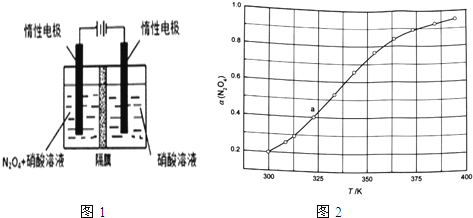
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H= .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为P0 , 第2.00min时体系压强为p,则p:p0= ;
1.00~3.00min内,O2的平均反应速率为 .
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
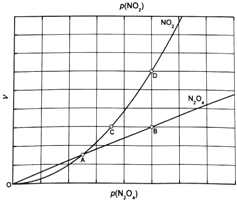
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由 ,若要提高N2O4转化率,除改变反应温度外,其他措施有 (要求写出两条).
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl= ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由 .