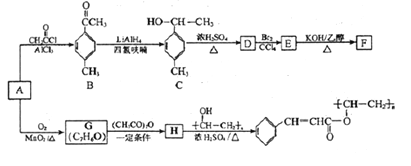
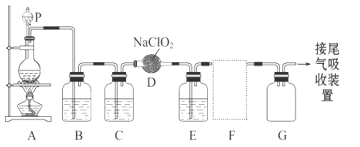
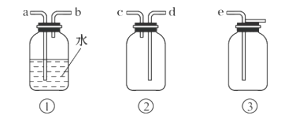
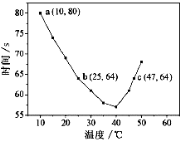
题目内容
【题目】物质的量相同的甲烷(CH4)和氨气(NH3),一定相同的量是( )
A.质量
B.体积
C.质子数
D.原子数
【答案】C
【解析】解:A、甲烷的相对分子质量为16,氨气的相对分子质量为17,物质的量相同时,二者质量不同,故A错误;B、因没有明确气体存在的条件,物质的量相等时,二者体积不一定相等,故B错误;
C、1个甲烷分子含有10个质子,1个氨气分子含有10个质子,相同物质的量的甲烷和氨气的质子数相等,故C正确;
D、1个甲烷含有5个原子,1个氨气含有4个原子,,相同物质的量的甲烷和氨气的含有的原子数不同,故D错误.
故选C.

【题目】(Ⅰ)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL/SPT) | 50 | 120 | 232 | 290 | 310 |
(1)上述时间段中(填0~1、1~2、2~3、3~4、4~5 min)反应速率最大的是
_____________min,其主要原因是_____________。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率__________________ 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号) __________ 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(Ⅱ)某同学做同周期元素性质递变规律实验时,自己设计了—套实验方案,并记录了有关实验现象如下表(表中的“实验方案”与“实验现象”前后不—定是对应关系)
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色。 |
②钠与滴有酚酞试液的冷水反应 | B.有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色。 |
③镁带与2mol/L盐酸反应 | C.反应不十分剧烈,产生的气体可以在空气中燃烧。 |
④铝条与2mol/L盐酸反应 | D.生成白色胶状沉淀,继而沉淀消失。 |
⑤向氯化铝溶液中滴加氢氧化钠溶液至过量 | E.剧烈反应,产生的气体可以在空气中燃烧。 |
请你帮助该同学整理并完成实验报告
(1)实验目的:_________________。
(2)实验用品:仪器:①砂纸,②试管,③胶头滴管,④酒精灯,⑤试管夹、试管架,⑥滤纸,⑦镊子,⑧小刀,⑨玻璃片,⑩锥形瓶(100mL)等;
药品:钠、镁条、铝条、2mol/L,的盐酸、AlCl3溶液、氢氧化钠溶液等。
(3)填写与实验方案相对应的实验现象(从上表“实验现象”中选择),并完成有关离子方程式
实验方案 | 实验现象(填写字母代号) | 有关离子方程式 |
① | _________ | Mg+2H2O(热水)==Mg(OH)2+H2↑ |
② | _________ | _____________________ |
③ | _________ | Mg+2H+==Mg2++H2↑ |
④ | _________ | ___________________ |
⑤ | _________ | Al3+ + 3OH- = Al(OH)3↓ |
___________________ |
(4)实验结论:_____________________
(5)该同学在本实验④中用去m克纯固体,反应完毕后无固体剩余,共收集到VL气体(SPT)下,该同学欲求此固体的原子量的表达式为________(用含m和V的式子表示)。