��Ŀ����
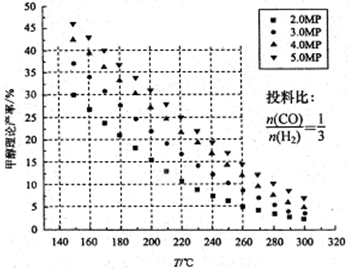
CO2�Ĺ̶��������ڽ������������ŷ��о�����Ҫ���ã���CO2����ϳɼ״�����������Ч�������ѹ�����������ۺ����õ�һ����;����CO2��H2�ڴ����������ܷ�����ӦCO2��3H2 CH3OH��H2O����ü״������۲����뷴Ӧ�¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
CH3OH��H2O����ü״������۲����뷴Ӧ�¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
��1����״����ʵĴ�ʩ�� ��
��2������ͼ�����ݿ�֪����220 �桢5MPaʱ��CO2��ת����Ϊ ���ٽ��¶Ƚ�����
140�棬ѹǿ��С��2MPa����ѧ��Ӧ���ʽ� �������С �� ���䡰 ��ͬ����CO2��ת���ʽ� ��
��3��200��ʱ����0.100molCO2��0.275molH2����1L�ܱ������У��ڴ��������·�Ӧ�ﵽƽ�⡣��CO2��ת����Ϊ25%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��(Ҫ��д����ʽ�ͼ�����)
��4����֪��֪��CO��ȼ���ȡ�H����283.0KJ/mol��2H2(g)+O2(g)��2H2O(g) ��H����483.6KJ/mol��
CO(g)+2H2(g)��CH3OH(g) ��H����90.1KJ/mol��д��CO2��H2�ϳɼ״����Ȼ�ѧ����ʽ ��
 CH3OH��H2O����ü״������۲����뷴Ӧ�¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
CH3OH��H2O����ü״������۲����뷴Ӧ�¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ش��������⣺
��1����״����ʵĴ�ʩ�� ��
��2������ͼ�����ݿ�֪����220 �桢5MPaʱ��CO2��ת����Ϊ ���ٽ��¶Ƚ�����
140�棬ѹǿ��С��2MPa����ѧ��Ӧ���ʽ� �������С �� ���䡰 ��ͬ����CO2��ת���ʽ� ��
��3��200��ʱ����0.100molCO2��0.275molH2����1L�ܱ������У��ڴ��������·�Ӧ�ﵽƽ�⡣��CO2��ת����Ϊ25%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��(Ҫ��д����ʽ�ͼ�����)
��4����֪��֪��CO��ȼ���ȡ�H����283.0KJ/mol��2H2(g)+O2(g)��2H2O(g) ��H����483.6KJ/mol��
CO(g)+2H2(g)��CH3OH(g) ��H����90.1KJ/mol��д��CO2��H2�ϳɼ״����Ȼ�ѧ����ʽ ��
��1�����¡���ѹ��2�֣� ��2��25%��2�֣� ��С��2�֣� ����2�֣�
��3��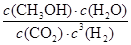 ��
��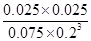 ��1.04 ��3�֣�
��1.04 ��3�֣�
��4��CO2(g)��3H2(g)===CH3OH(g)��H2O(g) ?H��-48.9 kJ/mol��3�֣�
��3��
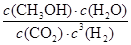 ��
��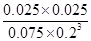 ��1.04 ��3�֣�
��1.04 ��3�֣���4��CO2(g)��3H2(g)===CH3OH(g)��H2O(g) ?H��-48.9 kJ/mol��3�֣�
�����������1������ͼ���֪�������¶ȵ����ߣ��״��IJ��ʽ��ͣ���˵������Ӧ�Ƿ��ȷ�Ӧ�����¶���ͬʱ������ѹǿ���״��IJ�������������״����ʵĴ�ʩ�ǽ��¡���ѹ��
��2������ͼ�����ݿ�֪����220 �桢5MPaʱ���״��IJ�����25%������̼ԭ���غ㣬1molCO2����1mol�״�����˼״��IJ��ʾ���CO2��ת���ʣ�����CO2��ת����Ϊ25%�����²�ͬʱ����ѹǿ����Ӧ���ʼ�С����������Ӧ�Ƿ��ȵ������С�Ŀ��淴Ӧ����˽��ºͽ���ѹǿƽ���������Ӧ�����ƶ�������CO2��ת��������
��3�� CO2(g)��3H2(g)===CH3OH(g)��H2O(g)
��ʼŨ�ȣ�mol/L��0.100 0.275 0 0
ת��Ũ�ȣ�mol/L��0.0250 0.0750 0.0250 0.0250
ƽ��Ũ�ȣ�mol/L��0.0750 0.200 0.0250 0.0250
���Ը��¶��·�Ӧ��ƽ�ⳣ��K��
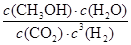 ��
��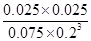 ��1.04
��1.04��4��CO��ȼ���ȡ�H����283.0KJ/mol�������Ȼ�ѧ����ʽ��2CO(g)��O2(g)��2CO2(g) ��H����566.0KJ/mol������Ϊ��Ӧ��2H2(g)+O2(g)��2H2O(g) ��H����483.6KJ/mol����CO(g)+2H2(g)��CH3OH(g) ��H����90.1KJ/mol�����Ը��ݸ�˹���ɿ�֪��(�ۡ�2���٣���)��2�����õ���ӦCO2(g)��3H2(g)===CH3OH(g)��H2O(g)�����Ը÷�Ӧ�ķ�Ӧ��?H������90.1KJ/mol��2��566.0KJ/mol��483.6KJ/mol����2��-48.9 kJ/mol��

��ϰ��ϵ�д�
�����Ŀ


 CH3OH(g)��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ����
CH3OH(g)��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ����


 2SO3(g) ��H����196.6 kJ��mol��1)����ش��������⣺
2SO3(g) ��H����196.6 kJ��mol��1)����ش��������⣺
 CH3COOC2H5(l)��H2O(l) ��H����8.62 kJ��mol��1
CH3COOC2H5(l)��H2O(l) ��H����8.62 kJ��mol��1



 CO2(g); ��H=��395.5 kJ��mol-1
CO2(g); ��H=��395.5 kJ��mol-1 CH3OH(g)+H2O(g) ��H����49.0 kJ/mol��
CH3OH(g)+H2O(g) ��H����49.0 kJ/mol��
 O2(g)�TCO2(g) ��H����283.0kJ/mol
O2(g)�TCO2(g) ��H����283.0kJ/mol CO2(g)��H2(g) ��H��0�ں����ܱ������У���ʼʱn(H2O)=0.20mol��n(CO)��0.10 mol,��8000Cʱ�ﵽƽ��״̬��K��1.0����ƽ��ʱ��������CO��ת������_____________(����������һλС��)��
CO2(g)��H2(g) ��H��0�ں����ܱ������У���ʼʱn(H2O)=0.20mol��n(CO)��0.10 mol,��8000Cʱ�ﵽƽ��״̬��K��1.0����ƽ��ʱ��������CO��ת������_____________(����������һλС��)�� 2NH3(g)����H��0���ڵ��������½��У��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
2NH3(g)����H��0���ڵ��������½��У��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��