题目内容
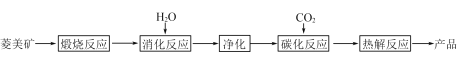
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
【答案】 70℃ 温度进一步升高同等幅度,转化率几乎不变。但能耗增加 Mg(OH)2+2CO2=Mg(HCO3)2 煅烧反应 热解反应 10-5 C 方案2 加入碳酸钠的产品中易混入更多杂质,不易提纯
【解析】(1)由图可知,70℃时,物质的转化率较大,但是温度进一步升高同等幅度,转化率几乎不变,但能耗增加;
(2)由流程图可知Mg(HCO3)2由Mg(OH)2和2CO2反应而来,反应为:Mg(OH)2+2CO2═Mg(HCO3)2;
(3)煅烧反应中碳酸镁和碳酸钙生成二氧化碳,热解反应生成二氧化碳;
(4)①已知:Ksp(Mn(OH)2)=10-14,常温时当调节溶液pH为9.5时,c(OH-)=10-4.5,此时Mn2+小于不沉淀,则c(Mn2+)c(OH-)2<Ksp(Mn(OH)2)=10-14,则c(Mn2+)<![]() =10-5;
=10-5;
②把Fe2+转化为Fe3+,从环境角度选择过氧化氢的产物为水,不污染环境,故答案为C;
③利用卤水碳化法制取轻质碳酸镁,方案1中加入碳酸钠的产品中易混入更多杂质,不易提纯,故方案2更合适。

【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2 = S4O62- + 2I- 。
(Ⅰ)制备Na2S2O3·5H2O
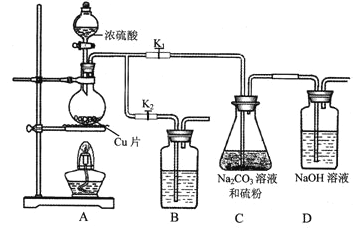
①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热。圆底烧瓶中发生反应的化学方程式为___________________________________________。
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。C中碳酸钠的作用是_____。“停止C中的反应”的操作是____________________。
③过滤C中的混合液。将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
④装置B中盛放的试剂是(填化学式)_____________溶液,其作用是__________________。
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示:
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
①滴定时,达到滴定终点的现象是______________________________。
②Na2S2O3·5H2O在产品中的质量分数是___________(用百分数表示,且保留1位小数)。
③下列操作中可能使测定结果偏低的是________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入I2的标准液
B.滴定前盛放Na2S2O3溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取I2标准液时,开始仰视读数,滴定结束时俯视读数