题目内容
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快 |
| B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
| C.“纳米铜”与铜是同素异形体 |
| D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快 |
B
解析试题分析:A.常温下“纳米铜”比铜片的与氧气的接触面积大,活动性强,反应时反应速率快。错误。B.Cu是固体,把Cu制成“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快。最强。C.“纳米铜”与铜都是Cu元素的同种单质,只是颗粒大小不同而已。错误。D.常温下“纳米铜”比铜片更易失去电子,反应时反应速率快。错误。
考点:考查“纳米铜”的性质的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
| A.该反应进行到M点放出的热量大于进行到W点放出的热量 |
B.T2下,在0~t1时间内,υ(Y)=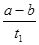 mol/(L·min) mol/(L·min) |
| C.M点的正反应速率υ正大于N点的逆反应速率υ逆 |
| D.M点时再加入一定量的X,平衡后X的转化率减小 |
在K2CrO4的溶液中存在着如下的平衡:2CrO42- + 2H+ Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
| A.>7 | B.<7 | C.=7 | D.无法确定 |
下列有关说法正确的是
| A.25oC与60oC时,纯水的pH相等 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
| A.降低温度 | B.恒容充入氮气 | C.恒压充入氦气 | D.恒容充入氦气 |
在一定温度下,反应A2(g) + B2(g)  2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
| A.单位时间内生成nmolA2同时生成nmolAB |
| B.容器内的总物质的量不随时间变化 |
| C.单位时间内生成2nmolAB的同时生成nmolB2 |
| D.单位时间内生成nmolA2的同时生成nmolB2 |
 2PbCrO4(s)+2H+(aq)△H<0
2PbCrO4(s)+2H+(aq)△H<0
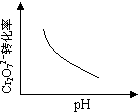
 2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( ) CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是
CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是