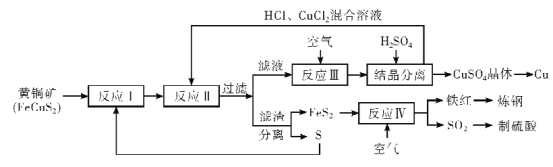
题目内容
【题目】通常人们把拆开 1 mol 某化学键所消耗的能量看作是该化学键的键能。键能的大小可衡量化学键的强弱,也可以估算化学反应的反应热。下表为某些化学键的键能
化学键 | N-N | O=O | N≡N | N-H |
键能(kJ/mol) | 154 | 500 | 942 | a |
已知火箭燃料肼(![]() )的有关化学反应的能量变化如图所示,则下列说法错误的是( )
)的有关化学反应的能量变化如图所示,则下列说法错误的是( )

A.N2比O2稳定
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol
C.表中的 a=194
D.图中的 ΔH3=+2218 kJ/mol
【答案】C
【解析】
A.N≡N的键能为942 kJ/mol,O=O 的键能为500kJ/mol,所以N2比O2稳定,A正确;
B.从图中可以看出,反应物为N2H4(g)+O2(g),生成物为N2(g)+2H2O(g),ΔH=-534 kJ/mol,B正确;
C.利用ΔH3建立有关a的等量关系,即ΔH3=154+4a+500=2218,a=391,C错误;
D.图中的 ΔH3=2752kJ/mol-534kJ/mol=+2218 kJ/mol,D正确;
故选C。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目