题目内容
已知下列热化学方程式:
Zn(s)+ O2(g)=ZnO(s) △H =-351.1kJ·mol-1
O2(g)=ZnO(s) △H =-351.1kJ·mol-1
Hg(l)+ O2(g)=HgO(s) △H =-90.7 kJ·mol-1
O2(g)=HgO(s) △H =-90.7 kJ·mol-1
由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为( )
Zn(s)+
 O2(g)=ZnO(s) △H =-351.1kJ·mol-1
O2(g)=ZnO(s) △H =-351.1kJ·mol-1Hg(l)+
 O2(g)=HgO(s) △H =-90.7 kJ·mol-1
O2(g)=HgO(s) △H =-90.7 kJ·mol-1由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为( )
| A.-260.4 kJ·mol-1 | B.-441.8 kJ·mol-1 |
| C.260.4 kJ·mol-1 | D.441.8 kJ·mol-1 |
A
试题分析:Zn(s)+HgO(s)=ZnO(s)+Hg(l)可以由Zn(s)+
 O2(g)=ZnO(s) 减去Hg(l)+
O2(g)=ZnO(s) 减去Hg(l)+ O2(g)=HgO(s)得到,所以Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为-351.1kJ·mol-1-(-90.7 kJ·mol-1)=-260.4 kJ·mol-1,故本题的答案选择A。
O2(g)=HgO(s)得到,所以Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为-351.1kJ·mol-1-(-90.7 kJ·mol-1)=-260.4 kJ·mol-1,故本题的答案选择A。点评:本题考查了晗的计算,该考点是高考考查的重点和热点,本题有注意晗变的符号,该题比较基础。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目

 2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H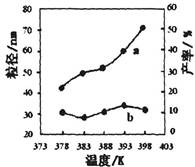
 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。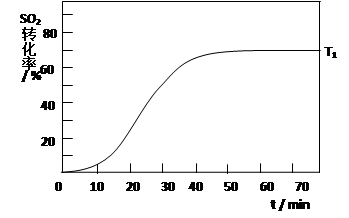
 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)

 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:


