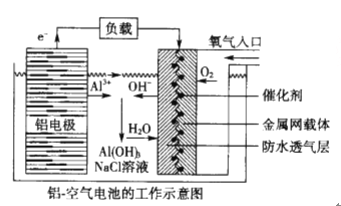
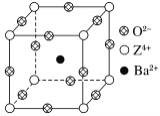
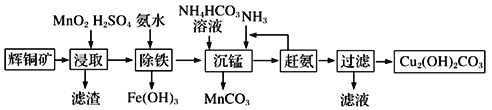
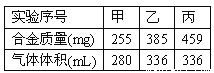
题目内容
【题目】下列描述中正确的是
A.BeCl2为V形的极性分子
B.ClO4的空间构型为正四面体形
C.P4和CH4都是正四面体分子且键角都为109°28′
D.H2O和CO32的中心原子均为sp3杂化
【答案】B
【解析】
A.BeCl2为中心原子的价层电子对数为![]() =2,不含孤对电子,所以分子的空间构型为直线形,正负电荷中心重合,所以为非极性分子,故A错误;
=2,不含孤对电子,所以分子的空间构型为直线形,正负电荷中心重合,所以为非极性分子,故A错误;
B.ClO4的中心原子的价层电子对数为![]() =4,不含孤对电子,所以空间构型为正四面体,故B正确;
=4,不含孤对电子,所以空间构型为正四面体,故B正确;
C.二者虽都是正四面体形分子,但白磷中键角为60°,CH4键角为109°28ˊ,故C错误;
D.水分子的中心原子价层电子对数为![]() =4,为sp3杂化,CO32的中心原子价层电子对数为
=4,为sp3杂化,CO32的中心原子价层电子对数为![]() =3,所以为sp2杂化,故D错误;
=3,所以为sp2杂化,故D错误;
故答案为B。

练习册系列答案
相关题目