题目内容
在一密闭容器中发生反应:2X(g)+Y(g) aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
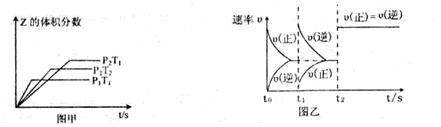
 aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
| A.图甲,P1>P2,a < 3 |
| B.图甲,T1<T2,Q>0 |
| C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体 |
| D.图乙,如果a=3, t2时表示向体系中加入了催化剂 |
C
试题解析:根据甲图像,温度相同时,P1>P2,增加压强Z的体积分数减小,平衡逆向移动,此时平衡是向气体分子总数减小方向移动,因此a>3,A错;根据甲图像,压强相同时,T1<T2,升高温度Z的体积分数减小,平衡逆向移动,此时平衡向吸热方向移动,因此逆反应吸热,Q<0,B错;从图像乙中看出,t1时刻,逆反应速率大于正反应速率,平衡逆向移动,但温度压强不变,改变因素必为浓度,逆反应速率明显大于正反应速率,故应是增大Z的浓度,C正确;a=3,则反应前后气体分子总数不变,若增大压强,正逆反应速率增大,但平衡不移动,符合乙图像,故D错。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
 2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):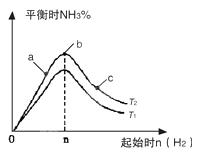
 4NO+6H2O ,4NH3+3O2
4NO+6H2O ,4NH3+3O2 cW(g)反应,当充入1 mol X和lmol Y,达到平衡时,W的浓度为0.2 mol/L。下列说法错误的是
cW(g)反应,当充入1 mol X和lmol Y,达到平衡时,W的浓度为0.2 mol/L。下列说法错误的是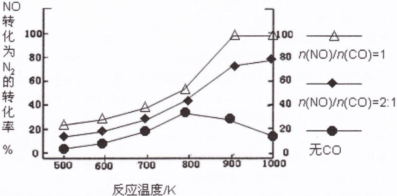
 CH3OH(g) △H
CH3OH(g) △H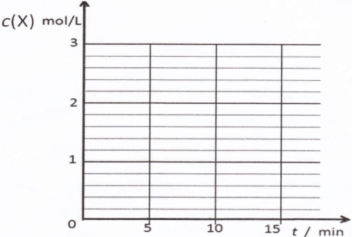
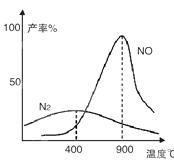
 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是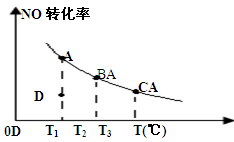
 CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )
CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )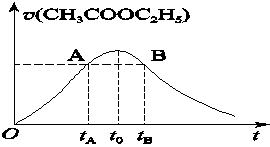
 2SO3的说法中,不正确的是
2SO3的说法中,不正确的是 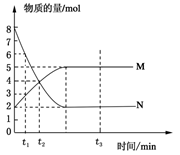
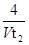 mol/(L?min)
mol/(L?min)