题目内容
某温度下在容积不变的密闭容器中,发生aX(g)+bY(g) cW(g)反应,当充入1 mol X和lmol Y,达到平衡时,W的浓度为0.2 mol/L。下列说法错误的是
cW(g)反应,当充入1 mol X和lmol Y,达到平衡时,W的浓度为0.2 mol/L。下列说法错误的是
 cW(g)反应,当充入1 mol X和lmol Y,达到平衡时,W的浓度为0.2 mol/L。下列说法错误的是
cW(g)反应,当充入1 mol X和lmol Y,达到平衡时,W的浓度为0.2 mol/L。下列说法错误的是| A.达到平衡时,消耗b mol Y的同时消耗c moI W |
| B.若升高温度,W的物质的量浓度减小,则该反应△H<0 |
| C.若起始投入X、Y的物质的量分别为amol和bmol,则平衡时X、Y的转化率相等 |
| D.在相同条件下,再充人l mol X和1 mol Y,达新平衡时,W的浓度为0.4 mol/L,则a+b>c |
D
试题分析:A、消耗b mol Y正向进行,同时消耗c moI W逆向进行,依据反应速率之比等于速率之比可知,反应达到平衡,故A正确;B、aX(g)+bY(g)
 cW(g),若升高温度,W的物质的量浓度减小,平衡左移,即逆向是吸热反应,所以正向是放热反应,则该反应△H<0,故B正确;C、若起始投入X、Y的物质的量分别为amol和bmol,到达平衡时,消耗的X、Y按照化学方程式计量数反应消耗,所以平衡时X、Y的转化率相等,故C正确;D、在相同条件下,再充人l mol X和1 mol Y,达新平衡时,W的浓度为0.4 mol/L,这说明平衡是等效的,因此a+b=c,故D错误,答案选D。
cW(g),若升高温度,W的物质的量浓度减小,平衡左移,即逆向是吸热反应,所以正向是放热反应,则该反应△H<0,故B正确;C、若起始投入X、Y的物质的量分别为amol和bmol,到达平衡时,消耗的X、Y按照化学方程式计量数反应消耗,所以平衡时X、Y的转化率相等,故C正确;D、在相同条件下,再充人l mol X和1 mol Y,达新平衡时,W的浓度为0.4 mol/L,这说明平衡是等效的,因此a+b=c,故D错误,答案选D。
练习册系列答案
相关题目
 aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
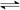 2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
 2Z,其平衡常数值为1600
2Z,其平衡常数值为1600 NH3(g) + HI(g)
NH3(g) + HI(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)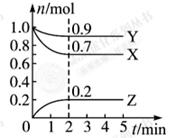
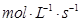 与用物质Y表示的化学反应速率为0.1
与用物质Y表示的化学反应速率为0.1