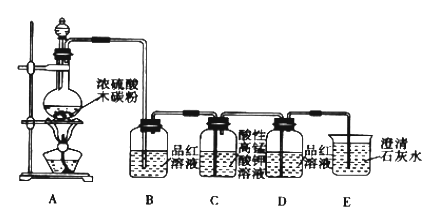
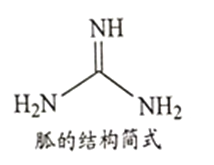
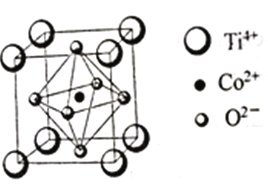
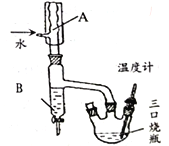
��Ŀ����
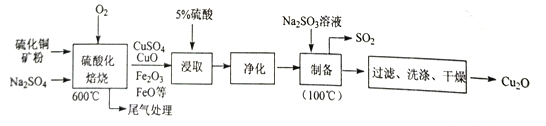
����Ŀ��25Cʱ����ˮ�в��ֺ��ȵ����ֵķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵İٷ֔�) ��pH�Ĺ�ϵ����ͼ��ʾ��

����������ȷ����
A. ���Ƶ�pH=1����ˮ�У�c(C13-)>c(HClO)>c(H+)
B. ������ˮ�г���ͨ��SO2��pH���ϱ�С����Һ��ɫ���ϼ���
C. 25��ʱ��HClO![]() H++ClO-�ĵ��볣��Ka�Ķ���ֵΪlgKa=-7.54
H++ClO-�ĵ��볣��Ka�Ķ���ֵΪlgKa=-7.54
D. pH=6����ˮ�м���NaOH��Һ����Ҫ���������ӷ�Ӧ����ʽΪHClO+OH-=ClO-+H2O
���𰸡�CD
��������A���ɵ���غ㣺c(H+)=c(OH- )+c(C13-)��c(H+)>c(C13-)����A����B��Cl2��SO2��2H2O=H2SO4��2HCl��pH���ϱ�С����Һ��ɫ�������B����C��25��ʱ��HClO![]() H++ClO-�ĵ��볣��Ka=
H++ClO-�ĵ��볣��Ka=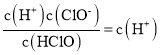 =10-7.54 ������ֵΪlgKa=-7.54����C��ȷ��D����ͼ����pH��HClO��Ũ�ȱ�С���Ƿ�Ӧ�ClO-����������������Ҫ���������ӷ�Ӧ����ʽΪHClO+OH-=ClO-+H2O����D��ȷ����ѡCD��
=10-7.54 ������ֵΪlgKa=-7.54����C��ȷ��D����ͼ����pH��HClO��Ũ�ȱ�С���Ƿ�Ӧ�ClO-����������������Ҫ���������ӷ�Ӧ����ʽΪHClO+OH-=ClO-+H2O����D��ȷ����ѡCD��

 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�����Ŀ��̼���仯�����ڹ�ũҵ������Ҫ���á�
������һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g�� ![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
T/�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��___________���÷�ӦΪ__________��������������������������Ӧ��
��2��ij�¶���ƽ��Ũ�ȷ�����ʽ�� c��CO2����c��H2����c��CO����c��H2O�������¶��¼���1 mol CO2��g����1 mol H2��g������ַ�Ӧ���ﵽƽ��ʱ��CO2��ת����Ϊ______________��
��3����800 ��ʱ����������Ӧ��ijʱ�̲�������ڸ����ʵ�Ũ�ȷֱ�Ϊc��CO2��Ϊ2 mol/L��c��H2��Ϊ1.5 mol/L��c��CO��Ϊ1 mol/L��c��H2O��Ϊ3 mol/L���������淴Ӧ���ʵıȽ�Ϊ��v��___________v������������������������������
��ҵ����CO2��H2��Ӧ�ϳɼ��ѡ���֪��
CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H1=-53.7kJmol-1
CH3OCH3��g��+H2O��g���T2CH3OH��g����H2=+23.4kJmol-1
��2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��g����H3=_______________kJ��mol-1��
CH3OCH3��g��+3H2O��g����H3=_______________kJ��mol-1��
�������ð�ˮ����CO2�ɵõ�NH4HCO3��Һ���ڸ���Һ�У�c��NH4+��________������>������<������������c��HCO3��������ӦNH4+��HCO3����H2O![]() NH3��H2O��H2CO3��ƽ�ⳣ��K��__________������֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb��2��10��5��H2CO3�ĵ���ƽ�ⳣ��K1��4��10��7��K2
NH3��H2O��H2CO3��ƽ�ⳣ��K��__________������֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb��2��10��5��H2CO3�ĵ���ƽ�ⳣ��K1��4��10��7��K2