题目内容
【题目】已知KMnO4 、浓硫酸、双氧水是常见的氧化剂。某小组同学用下图装置做浓硫酸与木炭反应的实验,以及检验生成的CO2和SO2。据此回答下列问题:
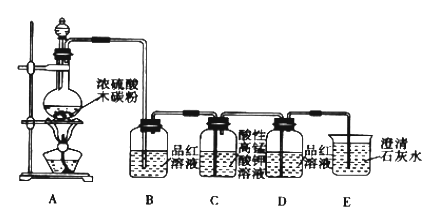
(1)木炭与浓H2SO4在加热条件下反应的化学方程式为:__________________________;
(2)装置B观察到的现象是品红溶液褪色,可确定该气体中含有_________________;说明该气体具有___________性;
(3)装置C中紫红色褪去,利用了SO2的还原性,MnO4-被还原为Mn2+,反应的离子方程式为________________________;还原剂与氧化剂的物质的量之比为_________;
(4)装置E观察到的现象是_______________________,该装置中发生的离子方程式是____________________________。
(5)若将装置A中生成的气体通入BaCl2溶液中是否产生沉淀?________(填“是”或“否”),如果通入Ba(NO3)2溶液中产生沉淀的化学式为_____________。
【答案】 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O SO2 漂白性 5SO2+2MnO4-+2H2O == 5SO42-+2Mn2++4H+ 5:2 澄清石灰水变浑浊 CO2+Ca2++2OH-==CaCaO3↓+H2O 否 BaSO4
CO2↑+2SO2↑+2H2O SO2 漂白性 5SO2+2MnO4-+2H2O == 5SO42-+2Mn2++4H+ 5:2 澄清石灰水变浑浊 CO2+Ca2++2OH-==CaCaO3↓+H2O 否 BaSO4
【解析】(1)木炭粉与浓硫酸发生反应产生SO2和CO2气体,反应的方程式为2H2SO4(浓)+C![]() 2SO2↑+CO2↑+2H2O,故答案为:2H2SO4(浓)+C
2SO2↑+CO2↑+2H2O,故答案为:2H2SO4(浓)+C![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(2)反应生成了SO2,可使品红褪色,体现了二氧化硫的漂白性,故答案为:SO2;漂白性;
(3)SO2具有还原性,可与酸性高锰酸钾发生氧化还原反应,反应的离子方程式为5SO2+2MnO4-+2H2O == 5SO42-+2Mn2++4H+,根据方程式,还原剂(SO2)与氧化剂(MnO4-)的物质的量之比为5:2,故答案为:5SO2+2MnO4-+2H2O == 5SO42-+2Mn2++4H+;5:2;
(4)产物中有CO2,与澄清石灰水发生CO2 +Ca2++2OH-=CaCO3↓+H2O,可观察到澄清石灰水变浑浊,故答案为:澄清石灰水变浑浊;CO2 +Ca2++2OH-=CaCO3↓+H2O;
(5)SO2和CO2溶于水生成了亚硫酸和碳酸,亚硫酸钡和碳酸钡都能溶于盐酸,因此不会有沉淀生成,硝酸能把亚硫酸根离子氧化为硫酸根离子,硫酸根离子与钡离子反应生成不溶于硝酸的硫酸钡沉淀,故答案为:否;BaSO4。





