题目内容
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用非常广泛。
(1)Co2+基态核外电子排布式为_________。
(2)制备[Co(H2O)6]2+反应为(NH4)2[Co(SCN)4] +6H2O= [Co(H2O)6(SCN)2+2NH4SCN。
①配合物[Co(H2O)6]2+中与Co2+形成配位键的原子是________(填元素符号);SCN-的空间构型为________(用文字描述)。
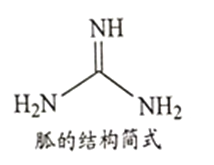
②NH4SCN在180-190℃分解并制得胍(结构简式如图所示),胍分子中氮原子杂化轨道类型为_________; 1mol 胍中含σ键数目为________。
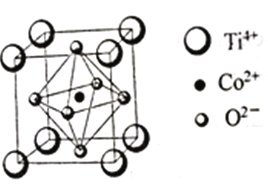
(3)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个(填数字)。
乙酸异戊酯是无色透明的液体,沸点142℃,可用作食品香料。合成方法如下:
CH3COOH+HO(CH2)2CH(CH3)CH3 ![]() CH3COO(CH2)2CH(CH3)CH3+H2O
CH3COO(CH2)2CH(CH3)CH3+H2O
步骤1.称取26.4g (0.3mol) 的异戊醇和21.6g (0.36mol) 乙酸,置于三口烧瓶中,加入适量FeCl3·6H2O 和几粒沸石。
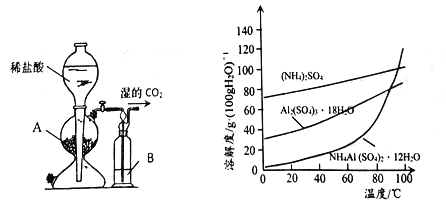
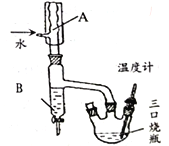
步骤2.装上温度计和仪器B (如右图),回流1h。
步骤3.稍冷后将仪器B 改为蒸馏装置,收集粗馏份。
步骤4.反应结束后分别用饱和食盐水、碳酸氢钠溶液和水分别洗涤、分液。
步骤5.加入2g 无水MgSO4,进一步操作得到乙酸异戊酯。
(1)图中仪器A名称为______,仪器B 的作用是_______
(2)步骤1控制投料比n(乙酸)/n(异戊醇)=1.2,其目的是__________
(3)步骤4用“碳酸氢钠溶液”洗涤的目的是_______; 分液时用到的主要玻璃仪器是______ (写名称)。
(4)步骤5 经MgSO4干燥后,_________得到乙酸异戊酯。
【答案】 1s22s22p63s3p63d7 或[Ar]3d7 O 直线形 sp2和sp3 8mol 8 球形冷凝管 及时分离出反应生成的水 提高异戊醇的转化率 除去过量的乙酸 分液漏斗 蒸馏,收集约142℃的馏分
【解析】(1)27号元素钴,Co2+基态核外电子排布式为1s22s22p63s3p63d7 或[Ar]3d7;(2)①H2O的O原子提供孤电子对,钴离子提供空轨道,配合物[Co(H2O)6]2+中与Co2+形成配位键的原子是O元素;SCN-的空间构型为与CO2是等电子体,为直线型;②胍分子中氮原子形成三个单键的杂化轨道类型为SP3杂化,形成一个双键的杂化轨道类型为SP2杂化,1mol 胍中含σ键数目为8mol ;(3)观察最上面的平面的中心有一个O2-,其上下两个平面中分别有四个O2-,晶体中与每个O2-紧邻的O2-有8个。
(1)图中仪器A冷凝回流末反应的反应物,A名称为球形冷凝管,仪器B 的作用是及时分离出反应生成的水;(2)步骤1控制投料比n(乙酸)/n(异戊醇)=1.2,乙酸过量,增大乙酸的浓度,其目的是提高异戊醇的转化率;(3)步骤4用“碳酸氢钠溶液”洗涤的目的是除去过量的乙酸,分液时用到的主要玻璃仪器是分液漏斗;(4)步骤5 经MgSO4干燥后,蒸馏,收集约142℃的馏分,得到乙酸异戊酯。