题目内容
【题目】Cu2O是一种几乎不溶于水的氧化物,在涂料、玻璃等领域应用非常广泛。一种以硫化铜矿石(含CuFeS2、Cu2S 等) 为原料制取Cu2O 的工艺流程如下:
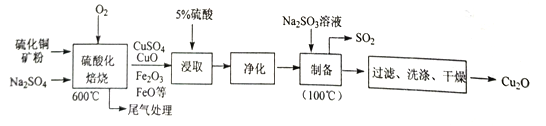
(1)“硫酸化焙烧”时:①硫化铜矿需粉碎的目的是_________;②CuS 与O2反应生成CuSO4等物质的化学方程式为________;③加入Na2SO4的作用除减小物料间黏结外,另一主要作用是__________。
(2)“浸取”时为提高铜的浸取率,除需控制硫酸的浓度外,还需控制_________ (至少列举两点)。
(3)“制备”时,溶液的pH与Cu2O 的产率关系如右图所示。
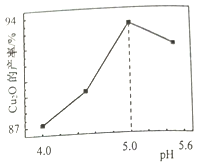
①在100℃时,发生反应的离子方程式为__________
②图中在4<pH<5 时,pH越小产率越低且产品中杂质Cu的含量越高,是因为________。
【答案】 提高硫化铜矿的利用率 2Cu2S+5O2![]() 2CuSO4+2CuO 提高焙烧产物中CuSO4比例 浸取温度、浸取时间、液固物质的量之比、焙烧产物颗粒的直径等 2Cu2++3SO32-
2CuSO4+2CuO 提高焙烧产物中CuSO4比例 浸取温度、浸取时间、液固物质的量之比、焙烧产物颗粒的直径等 2Cu2++3SO32-![]() Cu2O↓+SO42-+2SO2↑ pH越小时Cu2O越易与H+发生反应,生成Cu和Cu2+
Cu2O↓+SO42-+2SO2↑ pH越小时Cu2O越易与H+发生反应,生成Cu和Cu2+
【解析】(1)“硫酸化焙烧”时:①硫化铜矿需粉碎的目的是增大接触面积,提高硫化铜矿的利用率;②CuS 与O2反应生成CuSO4等物质的化学方程式为 2Cu2S+5O2![]() 2CuSO4+2CuO;③加入Na2SO4的作用除减小物料间黏结外,另一主要作用是增大SO42-浓度,提高焙烧产物中CuSO4比例;(2)“浸取”时为提高铜的浸取率,除需控制硫酸的浓度外,还需控制 浸取温度、浸取时间、液固物质的量之比、焙烧产物颗粒的直径等;(3)①在100℃时,Cu2+还原成Cu2O,SO32-氧化成SO42-,发生反应的离子方程式为 2Cu2++3SO32-
2CuSO4+2CuO;③加入Na2SO4的作用除减小物料间黏结外,另一主要作用是增大SO42-浓度,提高焙烧产物中CuSO4比例;(2)“浸取”时为提高铜的浸取率,除需控制硫酸的浓度外,还需控制 浸取温度、浸取时间、液固物质的量之比、焙烧产物颗粒的直径等;(3)①在100℃时,Cu2+还原成Cu2O,SO32-氧化成SO42-,发生反应的离子方程式为 2Cu2++3SO32-![]() Cu2O↓+SO42-+2SO2↑ ;②图中在4<pH<5 时,pH越小产率越低且产品中杂质Cu的含量越高,是因为pH越小时Cu2O越易与H+发生反应,生成Cu和Cu2+。
Cu2O↓+SO42-+2SO2↑ ;②图中在4<pH<5 时,pH越小产率越低且产品中杂质Cu的含量越高,是因为pH越小时Cu2O越易与H+发生反应,生成Cu和Cu2+。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案