题目内容
【题目】如图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况.达到平衡后,改变压强,平衡不移动.下列说法中正确的是( ) 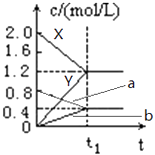
A.Z物质的变化情况为曲线b
B.该反应的化学方程式为:2X(g)3Y(g)+Z(g)
C.0→t1 , X的物质的量浓度变化量为1.2mol/L
D.若t1=1min,则v(Y )=0.02molL﹣1s﹣1
【答案】D
【解析】 解:A、达到平衡后,改变压强,平衡不移动,所以该反应是前后数气体计量数不变的反应,根据反应中物质的量之比等于计量数之比,设容器为1L,则△n(X)=0.8mol,△n(Y)=0.8mol,△n(Z)=0.8mol,因为前后计量数相等,所以Z为反应物,不是生成物,Z的物质的量减小,故A错误;
B、达到平衡后,改变压强,平衡不移动,所以该反应是前后数气体计量数不变的反应,根据反应中物质的量之比等于计量数之比,设容器为1L,则△n(X)=0.8mol,△n(Y)=0.8mol,△n(Z)=0.8mol,因为前后计量数相等,所以方程式为2X(g)+Z(g)3Y(g),故B错误;
C、0→t1 , X的物质的量浓度变化量为2.0mol/L﹣1.2mol/L=0.8mol/L,故C错误;
D、根据v= ![]() 可知,v(Y )=
可知,v(Y )= ![]() =
= ![]() =0.02molL﹣1s﹣1 , 故D正确;
=0.02molL﹣1s﹣1 , 故D正确;
故选D.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目