题目内容
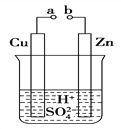
【题目】(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。(填“A”或“B”)
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
则生成1mol水可以放出热量 _____kJ
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:
_________________(填序号),写出反应⑥的化学方程式________。
【答案】 A 242 ③ ④ ⑤ Ba(OH)2·8H2O+2NH4Cl=BaCl2 + 2NH3 ↑+ 10H2O或2NH3 ·H2O + 8H2O
【解析】试题分析:2H2 + O2 = 2H2O是放热反应,反应物的总能量大于生成物的总能量;反应物的总键能-生成物的总键能=放出的热量。(2)放热反应主要有化合反应、中和反应、燃烧反应;吸热反应主要有分解反应、以C为还原剂的氧化还原反应、铵盐与碱的反应;
解析:2H2 + O2 = 2H2O是放热反应,反应物的总能量大于生成物的总能量,能正确表示该反应中能量变化的是A;根据2H2 + O2 = 2H2O,反应放热2×436+496-4×463=484kJ/mol,生成1mol水可以放出热量242 kJ。(2)放热反应主要有化合反应、中和反应、燃烧反应;吸热反应主要有分解反应、以C为还原剂的氧化还原反应、铵盐与碱的反应;属于放热反应的有③炸药爆炸 ④酸与碱的中和反应;Ba(OH)2·8H2O与NH4Cl反应生成氯化钡、氨气、水,化学方程式为Ba(OH)2·8H2O+2NH4Cl=BaCl2 + 2NH3 ↑+ 10H2O。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】原电池是化学对人类的一项重大贡献。
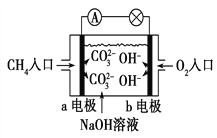
(1)某兴趣小组为研究原电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是 _________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是____________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子, 则理论上Zn片质量减轻________g。
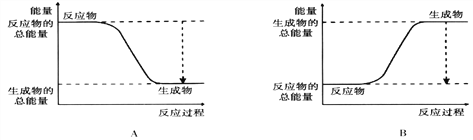
(2)如图是甲烷燃料电池原理示意图B,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。