题目内容
【题目】某溶液中Cl-、Br-、I-三者个数之比是1∶2∶3,通入一定量的Cl2,当反应完成后,该比值变为3∶2∶1,则反应的Cl2与原溶液中I-的个数之比是( )
A. 1∶2 B. 1∶3 C. 1∶4 D. 1∶6
【答案】B
【解析】试题分析:设原溶液中Cl-、Br-、I-三者物质的量分别是1mol、2 mol、3 mol,反应完后变为3 mol、2 mol、1 mol,只有I-和氯气发生反应,消耗I- 2mol,根据方程式消耗I- 2mol需要氯气1mol;反应的Cl2和原溶液中I-的物质的量之比是1:3。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
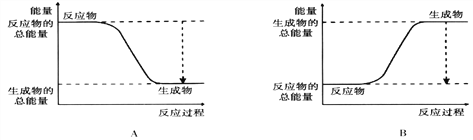
【题目】(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。(填“A”或“B”)
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
则生成1mol水可以放出热量 _____kJ
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:
_________________(填序号),写出反应⑥的化学方程式________。