题目内容
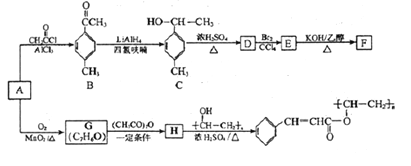
【题目】NaCl是一种化工原料,可以制备一系列物质(如图)。下列说法正确的是()

A. 25℃,NaHCO3在水中的溶解度比Na2CO3的大
B. 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C. 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D. 如图所示转化反应都是氧化还原反应
【答案】B
【解析】A、25℃,NaHCO3在水中的溶解度比Na2CO3的小,选项A错误;B、石灰乳与Cl2的反应中氯发生歧化反应,Cl2既是氧化剂,又是还原剂,选项B正确;C、常温下干燥的Cl2能用钢瓶贮存仅代表常温Cl2不与铁反应,加热、高温时可以反应,选项C错误;D、氯化钠转化为碳酸氢钠和碳酸氢钠转化为碳酸钠的反应都不属于氧化还原反应,选项D错误。答案选B。

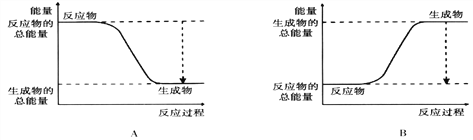
【题目】(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。(填“A”或“B”)
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
则生成1mol水可以放出热量 _____kJ
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:
_________________(填序号),写出反应⑥的化学方程式________。
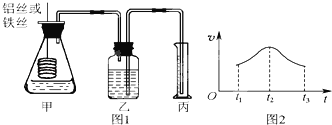
【题目】(Ⅰ)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL/SPT) | 50 | 120 | 232 | 290 | 310 |
(1)上述时间段中(填0~1、1~2、2~3、3~4、4~5 min)反应速率最大的是
_____________min,其主要原因是_____________。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率__________________ 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号) __________ 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(Ⅱ)某同学做同周期元素性质递变规律实验时,自己设计了—套实验方案,并记录了有关实验现象如下表(表中的“实验方案”与“实验现象”前后不—定是对应关系)
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色。 |
②钠与滴有酚酞试液的冷水反应 | B.有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色。 |
③镁带与2mol/L盐酸反应 | C.反应不十分剧烈,产生的气体可以在空气中燃烧。 |
④铝条与2mol/L盐酸反应 | D.生成白色胶状沉淀,继而沉淀消失。 |
⑤向氯化铝溶液中滴加氢氧化钠溶液至过量 | E.剧烈反应,产生的气体可以在空气中燃烧。 |
请你帮助该同学整理并完成实验报告
(1)实验目的:_________________。
(2)实验用品:仪器:①砂纸,②试管,③胶头滴管,④酒精灯,⑤试管夹、试管架,⑥滤纸,⑦镊子,⑧小刀,⑨玻璃片,⑩锥形瓶(100mL)等;
药品:钠、镁条、铝条、2mol/L,的盐酸、AlCl3溶液、氢氧化钠溶液等。
(3)填写与实验方案相对应的实验现象(从上表“实验现象”中选择),并完成有关离子方程式
实验方案 | 实验现象(填写字母代号) | 有关离子方程式 |
① | _________ | Mg+2H2O(热水)==Mg(OH)2+H2↑ |
② | _________ | _____________________ |
③ | _________ | Mg+2H+==Mg2++H2↑ |
④ | _________ | ___________________ |
⑤ | _________ | Al3+ + 3OH- = Al(OH)3↓ |
___________________ |
(4)实验结论:_____________________
(5)该同学在本实验④中用去m克纯固体,反应完毕后无固体剩余,共收集到VL气体(SPT)下,该同学欲求此固体的原子量的表达式为________(用含m和V的式子表示)。