题目内容
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。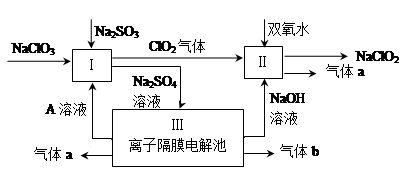
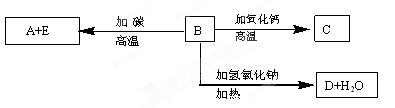
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
① 该反应中氧化剂和还原剂的物质的量之比是 。
② 研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是 。
(1)Na2SO3 H2O(2分)
(2)2ClO2 + H2O2 + 2OH- = 2ClO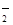 + O2↑+ 2H2O(2分)
+ O2↑+ 2H2O(2分)
(3)H2SO4(2分) 阳 (2分)
(4)1∶4 (2分) ClO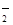 的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2 (2分)
的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2 (2分)
(5)NaClO2变质前后分别与Fe2+反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同(2分)
解析试题分析:(1)Ⅰ中发生的反应是亚硫酸钠被氯酸钠氧化,、Ⅲ中发生的反应是电解水,因此在这两个反应中还原剂分别是:Na2SO3 H2O(2分)
(2)2ClO2 + H2O2 + 2OH- = 2ClO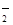 + O2↑+ 2H2O(2分)
+ O2↑+ 2H2O(2分)
(3)Ⅲ装置中左边氢氧根离子放电,剩余的氢离子跟硫酸根离子结合成硫酸,所以A是:H2SO4; 因为是氢氧根离子放电,所以这边是电解池的阳极。
(4)在这个反应中发生的是亚氯酸钠中氯元素的自身氧化还原反应,既作氧化剂,也作还原剂,作氧化剂的亚氯酸钠是化合价降低的,也就是由正三价变成正一价,为一摩尔,作还原剂的亚氯酸钠是化合价升高的,也就是由正三价变成正四价,为四摩尔,所以该反应中氧化剂和还原剂的物质的量之比是1∶4 ;ClO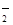 的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2 。
的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2 。
(5)NaClO2变质前后分别与Fe2+反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同(2分)
考点:氧化还原反应的有关知识。

光纤预制棒是光缆生产的最“源头”项目,目前国内光缆生产厂家约200家,大部分靠买进口光纤预制棒来生产光缆。
(1)光纤预制棒跟光导纤维的成分相同,那么光纤预制棒的化学成分是 。
(2)如果把光缆裸露在碱性土壤中,结果会短路,用离子方程式说明原因 。
(3)下列说法正确的是 。
| A.石英与普通玻璃都是硅酸盐制品 |
| B.二氧化硅是良好的半导体材料 |
| C.工艺师用盐酸刻蚀石英制作艺术品 |
| D.石英与二氧化碳中的化学键相同 |
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题: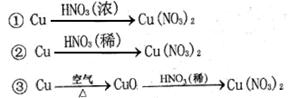
(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性,实验室不能用浓硫酸干燥氨气,说明硫酸具有 性。
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是 (填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
(4) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,则反应的化学方程式为 。