题目内容
16.下列变化需要加入氧化剂才能实现的是( )| A. | S2-→HS- | B. | Cu2+→Cu | C. | S→S2- | D. | Cl-→Cl2 |
分析 需要加入氧化剂才能实现,说明给予物质作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:A.该反应中S元素化合价不变,所以发生复分解反应即可生成,如硫化钠和硫化氢反应生成硫氢化钠,故A错误;
B.该反应中Cu元素化合价由+2价变为0价,所以铜离子作氧化剂,需要还原剂才能实现,如Fe等,故B错误;
C.该反应中S元素化合价由0价变为-2价,则S作氧化剂,需要还原剂才能实现,如氢气等,故C错误;
D.该反应中Cl元素化合价由-1价变为0价,氯离子失电子作还原剂,需要氧化剂才能实现,如二氧化锰等,故D正确;
故选D.
点评 本题以氧化还原反应为载体考查基本概念、基本理论,明确元素化合价与元素性质关系是解本题关键,知道常见元素化合价,题目难度不大.

练习册系列答案
相关题目
7.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 16克O2中含电子数为NA | |
| B. | 用溶有1 mol FeCl3的饱和溶液制Fe(OH)3胶体,制成的胶体中含有胶粒数为1.0 NA | |
| C. | 1mol镁与足量盐酸完全反应转移的电子总数为2NA | |
| D. | 22.4L任何气体的分子数为NA |
4.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol H2O含有的质子数为NA | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为8NA | |
| D. | 23g钠在化学反应中失去电子数目为10 NA |
11.工业上利用反应3Cl2+2NH3═N2+6HCl检验氯气管道是否漏气.关于该反应,下列说法正确的是( )
| A. | NH3被还原 | B. | Cl2是氧化剂 | ||
| C. | NH3中N的化合价为-3 | D. | 该反应中Cl2表现还原性 |
1.向Fe(OH)3胶体中逐滴加入一种液体,首先发生凝聚而沉淀,然后继续加入时沉淀又消失.这种加入的液体可能是下列物质中的( )
| A. | 0.05mol•L-1的H2SO4溶液 | B. | 0.05mol•L-1的MgSO4溶液 | ||
| C. | 0.05mol•L-1的KCl溶液 | D. | 蒸馏水 |
8.在潜水艇中和防毒面具中也用来消除CO2的是( )
| A. | Na2CO3 | B. | NaOH | C. | Na2O | D. | Na2O2 |
5.下列应用或事实与胶体的性质没有关系的是( )
| A. | 在河流入海口处易形成三角州 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 尿毒症患者做“血液透析” | |
| D. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 |
6.关于氨基酸的叙述错误的是( )
| A. | 人体内氨基酸的分解代谢最终产物是水、二氧化碳和尿素 | |
| B. | 构成蛋白质的氨基酸分子的结构通式可以表示为: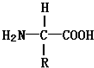 | |
| C. | 氨基酸只能和碱反应不能和酸反应 | |
| D. | 两个氨基酸通过脱水缩合形成二肽 |