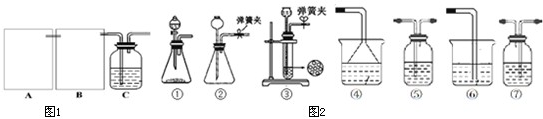
题目内容
5.请回答以下有关硝基苯、乙烯等实验室制法及性质的有关问题.I.实验室制备硝基苯的主要步骤如下:
(1)配制一定比例的浓硫酸和浓硝酸的混合酸的操作是先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却.
(2)向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀.
(3)在 50℃~60℃下发生反应常采用水浴加热.
(4)除去混合酸后,粗产品需进一步精制,下面操作正确的顺序为C.
①蒸馏②水洗③用干燥剂干燥 ④用5%的NaOH溶液洗⑤水洗
A.②④③①⑤B.⑤③①②④C.②④⑤③①D.④⑤③①②
(5)硝基苯不属于(填“属于”、“不属于”)烃,官能团是-NO2(写结构简式)
Ⅱ.为了探究乙烯与溴水的反应是加成而不是取代反应,某同学设计如下实验,请你帮助完成:
①测定溴水的pH
②将纯净的乙烯通入溴水中至溶液完全褪色③测定反应后溶液的pH值.
若pH值会略有增大或接近7,则反应为加成反应.
Ⅲ.下列有关实验的叙述正确的是AE.
A.石油的蒸馏实验中,加入碎瓷片可防止油在蒸馏时发生暴沸
B.石蜡油分解实验产物只有烯烃
C.制取乙酸乙酯时,导管口要在饱和NaCl溶液的液面上
D.在淀粉溶液中加入少量稀硫酸,加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,无砖红色沉淀生成,说明淀粉未水解
E.乙醇可使酸性高锰酸钾溶液或酸性重铬酸钾溶液变色.
分析 I.(1)浓硫酸与浓硝酸混合放出大量的热,配制混酸应将浓硫酸中注入浓硝酸中,及时搅拌、冷却,防止溅出伤人;
(4)除去混合酸后,粗产品中主要含有苯、少量的酸、水等杂质,需进一步精制,操作为水洗、用5%的NaOH溶液洗、水洗、用干燥剂干燥、蒸馏;
(5)硝基苯中含有氮元素,不属于烃,硝基苯中官能团为硝基;
Ⅱ.根据乙烯与溴如果发生加成反应,则生成1,2-二溴乙烷,溶液的pH值会略有增大或基本不变,接近中性,如果发生取代反应,则生成溴化氢,溶液的酸性会明显增大,pH值会明显减小,据此答题;
Ⅲ.A.石油的蒸馏实验中,加入碎瓷片可防止石油在蒸馏时发生暴沸;
B.石蜡油分解实验产物有烯烃和烷烃等;
C.制取乙酸乙酯时,导管口要在饱和碳酸钠溶液的液面上;
D.在淀粉溶液中加入少量稀硫酸,加热后,先加入氢氧化钠溶液,将溶液调成碱性,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,无砖红色沉淀生成,说明淀粉未水解;
E.乙醇可被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化,而使酸性高锰酸钾溶液或酸性重铬酸钾溶液变色;
解答 解:I.(1)浓硫酸与浓硝酸混合放出大量的热,配制混酸操作注意事项是:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却,
故答案为:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却;
(4)除去混合酸后,粗产品中主要含有苯、少量的酸、水等杂质,需进一步精制,操作为水洗、用5%的NaOH溶液洗、水洗、用干燥剂干燥、蒸馏,故选C;
(5)硝基苯中含有氮元素,不属于烃,硝基苯中官能团为硝基,其结构简式为-NO2,
故答案为:不属于;-NO2;
Ⅱ.根据乙烯与溴如果发生加成反应,则生成1,2-二溴乙烷,溶液的pH值会略有增大或基本不变,接近中性,如果发生取代反应,则生成溴化氢,溶液的酸性会明显增大,pH值会明显减小,所以实验步骤是测定反应后溶液的pH值,若 pH值会略有增大或接近7,则反应为加成反应,
故答案为:测定反应后溶液的pH值;pH值会略有增大或接近7;
Ⅲ.A.石油的蒸馏实验中,加入碎瓷片可防止石油在蒸馏时发生暴沸,故A正确;
B.石蜡油分解实验产物有烯烃和烷烃等,故B错误;
C.制取乙酸乙酯时,导管口要在饱和碳酸钠溶液的液面上,故C错误;
D.在淀粉溶液中加入少量稀硫酸,加热后,先加入氢氧化钠溶液,将溶液调成碱性,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,无砖红色沉淀生成,说明淀粉未水解,故D错误;
E.乙醇可被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化,而使酸性高锰酸钾溶液或酸性重铬酸钾溶液变色,故E正确,
故选AE.
点评 本题考查有机实验,涉及硝基苯的制取、乙烯与溴水反应原理的探究等,侧重对基本操作的考查,有一定的综合性,难度中等,答题时注意实验基础知识的灵活运用.

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案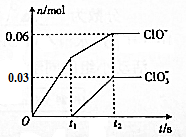 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )| A. | 3:7 | B. | 7:3 | C. | 3:2 | D. | 2:3 |
| A. | 反应①是熵减小的反应,而反应②是熵增大的反应 | |
| B. | 反应②高温时能自发迸行.是由于生成CO2使熵值增大 | |
| C. | 上述事实说明的H2SiO3酸性有时比H2CO3强,有时比H2CO3弱 | |
| D. | H2CO3酸性强于H2SiO3,不能用反应②进行解释 |
 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH $→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/0C | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)加入沸石的作用是防止暴沸
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是:保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%
(8)已知正丁醛在碱性条件下可以被新制氢氧化铜氧化,写出该反应的化学方程式:CH3CH2CH2CHO+NaOH+2Cu(OH)2$\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O.
| A. | 0.3mol O2和 0.3mol H2O | |
| B. | 0.1mol H2SO4和3.6g H2O | |
| C. | 0.1mol MgSO4•7H2O和0.1mol C12H22O11(蔗糖) | |
| D. | 6.02×1023个CO2与0.1mol KMnO4 |
 将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题: