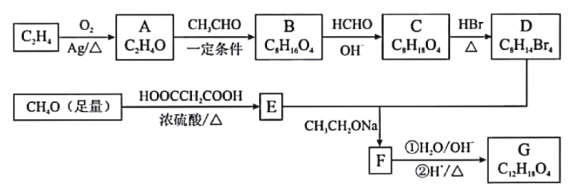
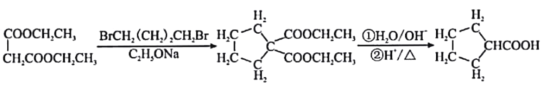
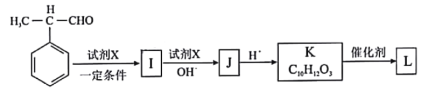
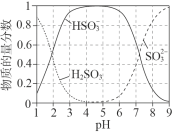
题目内容
【题目】下列关于氧化还原反应的说法正确的是
A.1mol Na2O2参与氧化还原反应,电子转移数一定为NA (NA为阿伏加德罗常数的值)
B.浓HCl和MnO2制氯气的反应中,参与反应的HCl中体现酸性和氧化性各占一半
C.VC可以防止亚铁离子转化成三价铁离子,主要原因是VC具有较强的还原性
D.NO2与水反应,氧化剂和还原剂的物质的量之比为2: 1
【答案】C
【解析】
A.Na2O2中的O为-1价,既具有氧化性又具有还原性,发生反应时,若只作为氧化剂,如与SO2反应,则1molNa2O2反应后得2mol电子;若只作为还原剂,则1molNa2O2反应后失去2mol电子;若既做氧化剂又做还原剂,如与CO2或水反应,则1molNa2O2反应后转移1mol电子,综上所述,1molNa2O2参与氧化还原反应,转移电子数不一定是1NA,A项错误;
B.浓HCl与MnO2制氯气时,MnO2表现氧化性,HCl一部分表现酸性,一部分表现还原性;此外,随着反应进行,盐酸浓度下降到一定程度时,就无法再反应生成氯气,B项错误;
C.维生素C具有较强的还原性,因此可以防止亚铁离子被氧化,C项正确;
D.NO2与水反应的方程式:![]() ,NO2中一部分作为氧化剂被还原价态降低生成NO,一部分作为还原剂被氧化价态升高生成HNO3,氧化剂和还原剂的物质的量之比为1:2,D项错误;
,NO2中一部分作为氧化剂被还原价态降低生成NO,一部分作为还原剂被氧化价态升高生成HNO3,氧化剂和还原剂的物质的量之比为1:2,D项错误;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】下表为元素周期表的一部分,请参照元素![]() 在表中的位置,用 化 学 用 语回答下列问题:
在表中的位置,用 化 学 用 语回答下列问题:
族 周期 | IA | 0 | ||||||
1 |
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 |
|
|
| |||||
3 |
|
|
|
| ||||
![]() 的原子结构示意图为_________。
的原子结构示意图为_________。
![]() 的气态氢化物分子的结构式为_____________。
的气态氢化物分子的结构式为_____________。
![]() 、
、![]() 的最高价含氧酸的酸性由强到弱的顺序是________________。
的最高价含氧酸的酸性由强到弱的顺序是________________。![]() 填化学式
填化学式![]()
![]() 、
、![]() 元素的金属性强弱依次为___________。
元素的金属性强弱依次为___________。![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]()
![]() 、
、![]() 、
、![]() 的形成的简单离子半径依次_______。
的形成的简单离子半径依次_______。![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]()
![]() 、
、![]() 元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。