题目内容
【题目】某实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
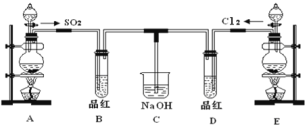
(1)实验室用装置E制备Cl2,其反应的离子方程式为__________________________;若有8mol的HCl参加反应,则转移的电子总数为________。
(2)该装置中氢氧化钠溶液的作用是___________________。
(3)通气后B、D两个试管中的现象______________。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________,D:________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用离子方程式表示)____________________。
【答案】MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ 4NA或2.408×1024 尾气处理,吸收过量的SO2和 Cl2 ,以防止污染环境 品红褪色 溶液变为红色 溶液无变化 SO2+Cl2+2H2O=4H++2Cl-+SO42-
Mn2++2H2O+Cl2↑ 4NA或2.408×1024 尾气处理,吸收过量的SO2和 Cl2 ,以防止污染环境 品红褪色 溶液变为红色 溶液无变化 SO2+Cl2+2H2O=4H++2Cl-+SO42-
【解析】
根据实验装置分析实验中涉及的化学反应;根据二氧化硫和氯气的化学性质分析解答问题。
A装置制备二氧化硫气体,B装置检验SO2气体,二氧化硫能使品红溶液褪色,E装置是将二氧化锰和浓盐酸共热的条件下反应生成氯气。
(1)实验室制备氯气可使用二氧化锰和浓盐酸共热的条件下反应生成氯气、氯化锰和水,方程式为:MnO2+4HCl![]() MnCl2+2H2O+Cl2↑,离子方程式为:MnO2+4H++2Cl-
MnCl2+2H2O+Cl2↑,离子方程式为:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑,其中盐酸中的Cl元素只有一半化合价升高,即4molHCl中只有2molHCl表现还原性,那么若有8mol的HCl参加反应,则只有4molHCl参与氧化还原反应,转移4mol电子,转移的电子总数为4NA;
Mn2++2H2O+Cl2↑,其中盐酸中的Cl元素只有一半化合价升高,即4molHCl中只有2molHCl表现还原性,那么若有8mol的HCl参加反应,则只有4molHCl参与氧化还原反应,转移4mol电子,转移的电子总数为4NA;
故答案为:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑,4NA或2.408×1024;
Mn2++2H2O+Cl2↑,4NA或2.408×1024;
(2)氯气和二氧化硫都有毒,所以根据图示分析,氢氧化钠的作用为尾气处理,吸收过量的SO2和 Cl2 ,以防止污染环境,
故答案为:尾气处理,吸收过量的SO2和 Cl2 ,以防止污染环境;
(3) 二氧化硫和氯气都可以使品红褪色,故通气后B、D两个试管中的现象是品红褪色;二氧化硫的漂白是因为二氧化硫和有色物质反应生成不稳定的无色物质,所以加热时,又会恢复颜色,而氯气的漂白是次氯酸的强氧化性,加热时颜色不会改变,
故答案为:品红褪色;溶液变为红色;溶液无变化;
(4)二氧化硫有还原性,氯气有氧化性,它们1:1混合会恰好完全反应生成硫酸和盐酸,而硫酸和盐酸没有漂白性,离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-;
故答案为:SO2+Cl2+2H2O=4H++2Cl-+SO42-。

【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Cu2(OH)2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NH3 | CaCl2 | MgO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D
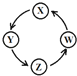
【题目】下列各组物质中,满足表中图示物质在一定条件下能一步转化的组合有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Al | AlCl3 | Al(OH)3 | Al2O3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ②③ B. ①③④ C. ①④ D. ①②③