题目内容
【题目】阿魏酸在食品、医药等方面有广泛用途。一种合成阿魏酸的反应可表示为:
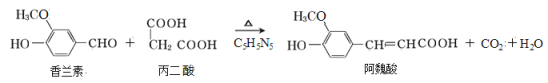
下列说法正确的是
A.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与Na2CO3、 NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有3种
【答案】B
【解析】
试题分析:A、能使酸性高锰酸钾溶液褪色的不仅有碳碳双键,酚羟基也能使其褪色.即使没有阿魏酸生成,原反应物中的香兰素同样可以使酸性高锰酸钾溶液褪色.故A错误;B、香兰素中含有酚羟基,阿魏酸中含有酚羟基和羧基,这两种官能团都可以与 Na2CO3、NaOH溶液反应,故B正确;C、香兰素、阿魏酸都能发生取代、加成,但它们都不能进行消去反应.故C错误;D、根据条件,其同分异构体为![]() 和
和![]() ,含有两个羟基且两个羟基和-CH2CHO为于相邻或相间时有两种结构,含有一个甲酸甲酯基和一个酚羟基,且二者处于相对位置,所以一共有5种同分异构体,故D错误;故选B。
,含有两个羟基且两个羟基和-CH2CHO为于相邻或相间时有两种结构,含有一个甲酸甲酯基和一个酚羟基,且二者处于相对位置,所以一共有5种同分异构体,故D错误;故选B。

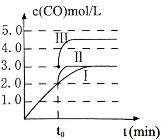
【题目】在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的主要作用力依次是
A.范德华力、范德华力、氢键
B.范德华力、范德华力、共价键
C.共价键、共价键、共价键
D.范德华力、氢键、共价键
【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显 价,B元素的核外电子排布式为 。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:

离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。

A.离子键
B.极性键
C.金属键
D.配位键
E.氢键
F.非极性键