题目内容
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 |
①实验1、2研究的是________________对H2O2分解速率的影响。
②实验2、3的目的是_______________。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性分析:如图甲可通过观察________________,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_______________。
②定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是_____________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是 热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是____________________的影响。要证明你的猜想,实验方案是 。
【答案】(1)①温度 ②比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异(或比较FeCl3溶液和MnO2对H2O2分解的催化效果)
(2)①反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰
②收集40mL气体所需时间
(3)①放 溶液温度升高,反应速率加快 ②催化剂(Mn2+的催化作用) 用两组酸性高锰酸钾溶液和草酸溶液作对比实验,一组加入少量MnSO4固体,一组不加,看反应速率快慢
【解析】
试题分析:(1)①分析实验1、2知实验1、2中其他条件相同,只有温度不同,故实验1、2研究的是温度对H2O2分解速率的影响;②实验2、3中其他条件相同,只是实验2的催化剂为MnO2,实验3的催化剂为FeCl3,故实验2、3的目的是 比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异(或比较FeCl3溶液和MnO2对H2O2分解的催化效果)。
(2)①为比较Fe3+、Cu2+对H2O2分解的催化效果,由于催化剂不同,催化效果不同,反应速率不同,产生的气泡快慢不同,故可通过观察反应产生气泡的快慢,定性比较得出结论。硫酸铜和氯化铁两种催化剂中阴离子是不同的,为排除阴离子的干扰,将CuSO4溶液改为CuCl2溶液更合理,其理由是控制阴离子相同,排除阴离子的干扰。②定量分析:实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,为测定反应速率,实验中需要测量的数据是 收集40 mL气体所需时间。
(3)①实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快,则可能的原因是KMnO4与H2C2O4的反应是放热反应,导致溶液温度升高,反应速率加快;②实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快,从影响化学反应速率的因素看,还可能是催化剂(Mn2+的催化作用)的影响。要证明该猜想的实验方案是用两组酸性高锰酸钾溶液和草酸溶液作对比实验,一组加入少量MnSO4固体,一组不加,看反应速率快慢。

【题目】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g)
M(g)+N(g)
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.20 | a |
④ | 800 | 0.10 | 0.10 | b |
下列说法正确的是 ( )
A. 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为50%
D. 实验④中,达到平衡时,b<0.05
【题目】为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
B | 硝基苯(苯) | 水 | 分液 |
C | 苯(苯酚) | 浓溴水 | 过滤 |
D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
A. AB. BC. CD. D
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是___________ (用化学式填写)。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为___________________________。
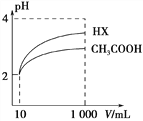
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)___醋酸溶液中水电离的c(H+) ;电离常数Ka(HX)___Ka(CH3COOH)(填“>”、“=”或“<”)。
(3)CO32- 、 NO2- 、CN-、CH3COO-结合H+的能力由强到弱的顺序为_______________________(用离子符号表示)