题目内容
【题目】I.一定温度下在2L的密闭容器内发生反应:H2(g)+I2(g)![]() 2HI(g),开始时通入0.8molH2和一定量的I2(g),各物质的浓度随时间的变化情况如图所示,其中I2(g)的浓度变化曲线前半部分已略去。
2HI(g),开始时通入0.8molH2和一定量的I2(g),各物质的浓度随时间的变化情况如图所示,其中I2(g)的浓度变化曲线前半部分已略去。

请回答下列问题:
(1)比较正反应速率(同一物质)的大小:A点_____(填“>”“≤”或“=”)B点。
(2)从反应开始至达到平衡,HI的平均反应速率为________。
(3)起始时I2的物质的量为______mol。
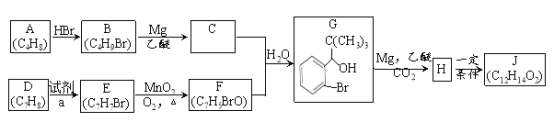
II.下图是煤综合利用的一种简单流程。已知烃A对氢气的相对密度是14,C为常见的酸味剂,E是一种有水果香味的透明液体。

(1)有机物D中含有的官能团的名称是___________。
(2)①~⑥过程中属于加成反应的是_______(填序号)。
(3)写出③的反应方程式____________。
(4)下列说法正确的是____(填字母)。
a.第①步是煤的液化,为煤的综合利用的一种方法
b.有机物C和D都可以与金属钠发生反应
c.有机物C和D的水溶液都具有杀菌消毒作用
d.有机物E与有机物D混合物的分离,可以用氢氧化钠溶液振荡、分液方法
【答案】 > 0.05 mol·L-1·min-1 0.6 羟基 ⑤ 2CO+3H2→CH3CHO+H2O bc
【解析】I.(1)根据A点未达到平衡状态,B点达到平衡状态判断。
(2)根据v=△c/△t计算。
(3)根据消耗碘的物质的量结合平衡时的物质的量计算起始时I2的物质的量。
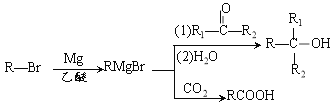
II.已知烃A对氢气的相对密度是14,A的相对分子质量是28,则A是乙烯。C为常见的酸味剂,乙烯氧化生成C,则C是乙酸。乙醛与氢气发生加成反应生成D是乙醇,E是一种有水果香味的透明液体,乙酸与D反应生成E,则E是乙酸乙酯。据此解答。
I.(1)根据图像可知A点反应未达到平衡状态,反应向正反应方向进行。B点反应已达到平衡状态,正逆反应速率相等,则比较正反应速率(同一物质)的大小为A点>B点。
(2)平衡时生成HI是0.5mol/L,则从反应开始至达到平衡,HI的平均反应速率为0.5mol/L÷10min=0.05 mol·L-1·min-1。
(3)平衡时生成碘化氢的物质的量是0.5mol/L×2L=1mol,根据方程式可知消耗碘的物质的量是0.5mol,平衡时碘的物质的量是0.05mol/L×2L=0.1mol,所以起始时I2的物质的量为0.6mol。
II.根据以上分析可知A是乙烯,C是乙酸,D是乙醇,E是乙酸乙酯。则
(1)有机物D是乙醇,其中含有的官能团的名称是羟基。
(2)①是煤的气化,②是一氧化碳和氢气合成乙烯,③是一氧化碳和氢气合成乙醛,④是氧化反应,⑤是乙醛的加成反应,⑥是酯化反应,则过程中属于加成反应的是⑤。
(3)根据原子守恒可知③的反应方程式为2CO+3H2→CH3CHO+H2O。
(4)a.第①步是煤的气化,为煤的综合利用的一种方法,a错误;b.有机物C和D分别是乙酸和乙醇,都可以与金属钠发生反应产生氢气,b正确;c.有机物C和D分别是乙酸和乙醇,其水溶液都具有杀菌消毒作用,c正确;d.乙酸乙酯在氢氧化钠溶液中水解,有机物E与有机物D混合物的分离,可以用饱和碳酸钠溶液振荡、分液方法,d错误。答案选bc。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是( )
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 向1mLlmol·L-1MgCl2溶液中滴加2滴2mol·L-1NaOH溶液,生成白色沉淀;再滴加2滴1mol·L-1'FeCl3溶液,白色沉淀变成红褐色沉淀 | 3Mg(OH)2(s)+2Fe3+(aq) |
B | 比较HClO和CH3COOH的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
D | 检验某溶液中是否含有SO42- | 向该溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
A. A B. B C. C D. D