��Ŀ����
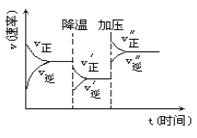
����Ŀ����֪A��B��CΪ���ֳ����ĵ��ʣ��ܷ�����ͼ1��ʾ��ת����ϵ��B��һ��ͬ��������ľ�����ͼ2��ʾ��

�ش��������⣺
��1���γ�A��Ԫ�������ڱ��е�λ����__________________________________��A��Ӧ�Ļ�̬ԭ�ӵļ۵����Ų�Ϊ_____________________��
��2����B���ʶ�Ӧ�Ļ�̬ԭ���У��������___________�����������෴�ĵ��ӡ�
��3��д��Y��һ�ֳ����ȵ�������ӵĽṹʽ__________________________��������ȽϷе�ϸߵ���__________���ѧʽ����Y������B��Ӧԭ�ӵ��ӻ���ʽΪ_________________��
��4�������A(Y)x�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿��ж�A(Y)x��������________________��������ͣ���A(Y)x������ԭ�Ӽ۵������������ṩ�ĵ�����֮��Ϊ18����x=__________��A(Y)x��һ�������·�����ӦA(Y)x (s) ![]() A (s) + x Y (g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ���γɵĻ�ѧ��������_____________��
A (s) + x Y (g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ���γɵĻ�ѧ��������_____________��
��5����ͼ2�����У�ÿ������ƽ��ռ��__________��ԭ�ӣ����������������ԭ�ӵľ���ΪL cm�������߳�Ϊa cm������Ӳ��Ӵ�ģ�ͣ���L=_________a���������ܶ���=___________g��cm-3���ú�a��NA����ʽ��ʾ����
���𰸡� �������ڵڢ��� 3d64s2 2 N��N CO sp ���Ӿ��� 5 ������ 8 ![]()
![]()
��������A��B��CΪ���ֳ����ĵ��ʣ���ˮ�����ڸ����·�Ӧ���ɵ���C����CΪ������A��B�ֱ�Ϊ����̼��B����ͬ�������壬��BΪ̼����AΪ�������XΪ������������YΪһ����̼��DΪ������̼��
(1)��Ԫ��Ϊ26��Ԫ�أ������ڱ��е�λ��Ϊ�������ڵ�VIII����A��Ӧ�Ļ�̬ԭ�ӵļ۵����Ų�Ϊ3d64s2���ʴ�Ϊ���������ڵ�VIII����3d64s2��
(2)C�Ļ�̬ԭ�ӵĵ����Ų�Ϊ1s22s22p2���������2�����������෴�ĵ��ӣ��ʴ�Ϊ��2��
(3)CO��һ�ֳ����ȵ��������Ϊ�������ṹʽΪN��N��COΪ���Է��ӣ�������ȽϷе�ϸߣ�CO������C��2��ԭ��������û�йµ��Ӷԣ�����sp�ӻ����ʴ�Ϊ��N��N��CO��sp��
(4)�����Fe(CO)x�����³�Һ̬���۵�Ϊ-20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ���Fe(CO)x���ڷ��Ӿ��塣��ԭ�ӵļ۵�����Ϊ8��Fe(CO)x������ԭ�Ӽ۵������������ṩ�ĵ�����֮��Ϊ18�����γɵ���λ��Ϊx=![]() =5��Fe(CO)5��һ�������·�����ӦFe(CO)5 (s)
=5��Fe(CO)5��һ�������·�����ӦFe(CO)5 (s) ![]() Fe(s) + 5CO (g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ�γ������еĽ��������ʴ�Ϊ�����Ӿ��壻5����������
Fe(s) + 5CO (g)����֪��Ӧ������ֻ������λ�����ɴ��жϸ÷�Ӧ�γ������еĽ��������ʴ�Ϊ�����Ӿ��壻5����������
(5)���ݾ����ṹ��ÿ������ƽ��ռ�е�ԭ����=8��![]() +6��
+6��![]() +4=8�����������������ԭ�ӵľ���Ϊ��Խ��߳��ȵ�
+4=8�����������������ԭ�ӵľ���Ϊ��Խ��߳��ȵ�![]() ����
����![]() acm=L cm�����������Ϊa3cm3������������Ϊ
acm=L cm�����������Ϊa3cm3������������Ϊ![]() g���������ܶ���=
g���������ܶ���=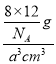 =
=![]() g��cm-3���ʴ�Ϊ��8��
g��cm-3���ʴ�Ϊ��8�� ![]() ��
�� ![]() ��
��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�