题目内容
17.已知短周期元素的离子aA-、bB2-、cC+、dD2+都具有相同的电子层结构,则下列叙述正确的是( )| A. | 原子半径为D>C>A>B | B. | 原子序数为a>b>c>d | ||
| C. | 离子半径为aA->bB2->cC+>dD2+ | D. | a+2=c |
分析 短周期元素的离子:aA-、bB2-、cC+、dD2+都具有相同的电子层结构,所以有:a+1=b+2=c-1=d-2,则原子序数:d>c>a>b,结合电荷可知,A、B为非金属性且同周期,C、D为金属性且同周期,并且C、D处于A、B的下一周期,同周期自左而右原子半径减小、同主族自上而下原子半径增大,电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:短周期元素的离子:aA-、bB2-、cC+、dD2+都具有相同的电子层结构,所以有:a+1=b+2=c-1=d-2,则原子序数:d>c>a>b,结合电荷可知,A、B为非金属性且同周期,C、D为金属性且同周期,并且C、D处于A、B的下一周期.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:C>D>B>A,故A错误;
B.离子电子层结构相同,核外电子数相同,则a+1=b+2=c-1=d-2,故原子序数:d>c>a>b,故B错误;
C.核电荷数d>c>a>b,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:bB2->aA->cC+>dD2+,故C错误;
D.离子电子层结构相同,核外电子数相同,则a+1=c-1,故a+2=c,故D正确,
故选D.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,清楚元素周期律的递变规律是解答该题的关键,也可以根据短周期元素与化合价推断具体的元素,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.今有A、B两种原子,A原子的M层比B原子的M层多1个电子,B原子的L层电子数是A原子L层电子数的一半.A和B分别为( )
| A. | Na和Mg | B. | Na和C | C. | Mg和Al | D. | C和Mg |
5.下列离子或分子组在溶液中能大量共存的是( )
| A. | K+ NO3- I- H2SO3 | B. | Na+ Fe3+ NO3- SCN- | ||
| C. | K+ AlO2- CO32- Al3+ | D. | NH4+ Mg2+ SO42- CH3COOH |
12.化学与社会、生产、生活密切相关,下列说法正确的是( )
| A. | 澳大利亚学者研究发现,夏季给鸡喂食碳酸水会使蛋壳变厚 | |
| B. | 陶瓷、水泥及所有玻璃都是硅酸盐产品 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | Cl2有漂白性,所以用Cl2可与石灰乳反应制备含氯消毒剂 |
6.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 原子核内有10个中子的氧原子:18O | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | CH4 分子的比例模型: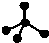 | D. | -CH3(甲基)的电子式为: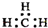 |
7.向明矾[KAl(SO4)2]溶液中滴入氢氧化钡溶液,当硫酸根离子恰好完全沉淀时,铝元素的存在形式是( )
| A. | 一部分为A1(OH)3,一部分为Al3+ | B. | 一部分为Al(OH)3,一部分为A1O2- | ||
| C. | 全部是Al(OH)3 | D. | 全部是A1O2- |
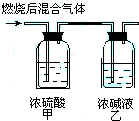 燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重10.8g,乙装置增重22g.求该烃的化学式.
燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重10.8g,乙装置增重22g.求该烃的化学式.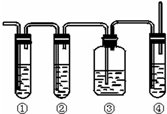 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4生成少量的SO2,有人设计下列实验以确认上述混合气体中有乙烯和SO2,试回答下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4生成少量的SO2,有人设计下列实验以确认上述混合气体中有乙烯和SO2,试回答下列问题: