题目内容
13.下列反应中,离子方程式书写正确的是( )| A. | 大理石与硝酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 过量CO2与澄清石灰水反应:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| C. | NH4HSO3与少量NaOH反应:NH4++HSO3-+20H-═NH3•H2O+SO32-+H2O | |
| D. | (NH4)2SO4与Ba(OH)2反应:2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O |
分析 A.碳酸钙为难溶物,离子方程式中不能拆开;
B.二氧化碳过量,反应生成碳酸氢钙;
C.氢氧化钠少量,亚硫酸氢根离子优先反应,铵根离子不反应;
D.硫酸铵与氢氧化钡溶液反应生成硫酸钡沉淀和一水合氨.
解答 解:A.大理石不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.过量的CO2和澄清石灰水反应生成HCO3-,反应的离子方程式为CO2+OH-═HCO3-,故B错误;
C.NH4HSO3与少量NaOH反应生成亚硫酸铵和水,正确的离子方程式为:HSO3-+0H-═SO32-+H2O,故C错误;
D.(NH4)2SO4与Ba(OH)2反应的离子方程式为:2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式;试题侧重考查反应物过量情况对生成物的影响,为易错点.

练习册系列答案
相关题目
3.下列关于纤维素的说法不正确的是( )
| A. | 是白色、无味的物质 | B. | 人体必需的营养物质 | ||
| C. | 水解的最终产物是葡萄糖 | D. | 没有还原性 |
4.已知化学反应:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1<0
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0
C(s)+O2(g)═CO2(g)△H3<0;
下列说法不正确的是(相同条件下)( )
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0
C(s)+O2(g)═CO2(g)△H3<0;
下列说法不正确的是(相同条件下)( )
| A. | 56g CO和32g O2所具有的总能量大于88g CO2所具有的总能量 | |
| B. | 12gC所具有的能量一定大于28gCO所具有的能量 | |
| C. | △H1+△H2=△H3 | |
| D. | 将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
8.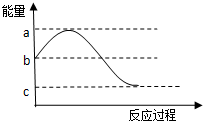 反应A(g)+3B (g)?2C(g)的能量变化如图所示,结合图象分析下列说法,其中正确的是( )
反应A(g)+3B (g)?2C(g)的能量变化如图所示,结合图象分析下列说法,其中正确的是( )
 反应A(g)+3B (g)?2C(g)的能量变化如图所示,结合图象分析下列说法,其中正确的是( )
反应A(g)+3B (g)?2C(g)的能量变化如图所示,结合图象分析下列说法,其中正确的是( )| A. | 若升高温度,则平衡常数增大 | |
| B. | 该反应的焓变为b-a | |
| C. | 达到平衡后,增大压强,平衡逆移 | |
| D. | 催化剂不影响反应的焓变,影响反应的活化能 |
2.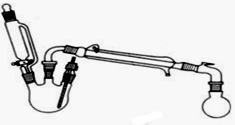 某研究性小组探究乙酸乙酯的反应机理,实验如下:
某研究性小组探究乙酸乙酯的反应机理,实验如下:
CH3COOH+C2H5OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
投料 1:1 CH3COOH转化率 65%
1:10 CH3COOH转化率 97%
(在120℃下测定)
已知:相关物理性质(常温常压)
合成反应:
在三颈瓶中加入乙醇5mL,硫酸5mL,2小片碎瓷片.漏斗加入乙酸14.3mL,乙醇20mL.冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120℃.
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾.最终通过蒸馏得到纯净的乙酸乙酯.
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪

用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样.这个实验推翻了酯化反应为简单的取代反应.请你设想酯化反应的机理先加成反应生成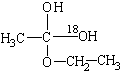 后脱水,失水有两种可能分别生成
后脱水,失水有两种可能分别生成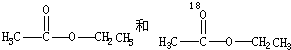 .
.
(2)酯化反应是一个可逆的反应,120℃时,平衡常数K=3.45.
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合?先向三颈烧瓶加入乙醇,再沿着瓶壁缓慢加入浓硫酸,边振荡边滴加.
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?保证乙醇量是乙酸量10倍以上,提高乙酸的转化率.
(6)蒸出的粗乙酸乙酯中主要有哪些杂质?乙醚、乙酸、乙醇和水.
饱和的Na2CO3溶液洗涤除去乙酸.如何判断是否除净?pH试纸检验不显酸性.
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?减少乙酸乙酯溶解.
 某研究性小组探究乙酸乙酯的反应机理,实验如下:
某研究性小组探究乙酸乙酯的反应机理,实验如下:CH3COOH+C2H5OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
投料 1:1 CH3COOH转化率 65%
1:10 CH3COOH转化率 97%
(在120℃下测定)
已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
在三颈瓶中加入乙醇5mL,硫酸5mL,2小片碎瓷片.漏斗加入乙酸14.3mL,乙醇20mL.冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120℃.
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾.最终通过蒸馏得到纯净的乙酸乙酯.
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪

用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样.这个实验推翻了酯化反应为简单的取代反应.请你设想酯化反应的机理先加成反应生成
 后脱水,失水有两种可能分别生成
后脱水,失水有两种可能分别生成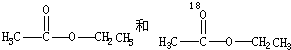 .
.(2)酯化反应是一个可逆的反应,120℃时,平衡常数K=3.45.
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合?先向三颈烧瓶加入乙醇,再沿着瓶壁缓慢加入浓硫酸,边振荡边滴加.
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?保证乙醇量是乙酸量10倍以上,提高乙酸的转化率.
(6)蒸出的粗乙酸乙酯中主要有哪些杂质?乙醚、乙酸、乙醇和水.
饱和的Na2CO3溶液洗涤除去乙酸.如何判断是否除净?pH试纸检验不显酸性.
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?减少乙酸乙酯溶解.
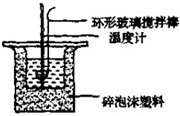 实验室利用右图装置进行中和热的测定,请回答下列问题:
实验室利用右图装置进行中和热的测定,请回答下列问题: