题目内容
9.设阿伏加德罗常数的数值为NA,下列说法正确的是( )| A. | 11.2L氮气所含的分子数为0.5NA | |
| B. | 16g CH4含有的电子数为8NA | |
| C. | 7.8gNa2O2与足量CO2反应,转移的电子数为0.1NA | |
| D. | 1L0.1mol•L-1的Na2S溶液中含有的S2-为0.1 NA |
分析 A、氮气所处的状态不明确;
B、求出甲烷的物质的量,然后根据甲烷为10电子微粒来分析;
C、质量换算物质的量,结合化学方程式计算电子转移数;
D、S2-为弱酸根离子,在溶液中会水解.
解答 解:A、氮气所处的状态不明确,故11.2L氮气的物质的量无法计算,故A错误;
B、16g甲烷的物质的量为1mol,而甲烷为10电子微粒,故1mol甲烷含10mol电子,故B错误;
C、7.8g Na2O2 物质的量为0.1mol,Na2O2 与过量CO2反应时,过氧化钠是自身氧化还原反应,2Na2O2+2CO2=2Na2CO3+O2;每2mol过氧化钠反应电子转移2mol,所以0.1mol过氧化钠反应转移的电子数为0.1NA,故C正确;
D、S2-为弱酸根离子,在溶液中会水解,故溶液中S2-的个数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则不可能的情形是( )
| A. | 由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 由0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合而成 | |
| C. | 由0.1 mol/LCH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| D. | 向上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
4.下列说法正确的是( )
| A. | 蛋白质溶液、淀粉溶液都属胶体 | |
| B. | 碳纤维、纤维素都是有机高分子 | |
| C. | 花生油,牛油互为同分异构体 | |
| D. | 普通玻璃、石英玻璃、水玻璃都是硅酸盐 |
14.下列离子方程式不正确的是( )
| A. | 纯碱溶液中滴加酚酞溶液显红色:CO32-+H2O?HCO3-+OH- | |
| B. | 烧碱溶液与小苏打溶液混合:OH-+HCO3-=H2O+CO32- | |
| C. | 硫代硫酸钠溶液与稀硫酸混合:3S2O32-+6H+=4S↓+3H2O+2SO2↑ | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
1.下列说法正确的是( )
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 蛋白质溶液中加入硫酸铜溶液,有白色沉淀产生,加水,白色沉淀重新溶解 | |
| C. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| D. | 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 |
18.下列各组离子在特定条件下能够大量共存的是( )
| A. | 无色溶液:SO42-、Cl-、Mg2+、NH4+ | |
| B. | 含有较多Ag+溶液:SO42-、K+、Na+、OH- | |
| C. | 能使石蕊试纸变红色的溶液:K+、SO32-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液:Na+、SO42-、AlO2-、K+ |
19.下列有关化学用于正确的是( )
| A. | NaHSO4的电离:NaHSO4=Na++H++SO${\;}_{4}^{2-}$ | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | S2-的结构示意图: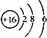 | |
| D. | 质子数为94,中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu |