题目内容
7. 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)?2Z(g)△H=-192kJ•mol-1.向M、N中都通入a mol X和b mol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变.下列说法一定正确的是( )
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)?2Z(g)△H=-192kJ•mol-1.向M、N中都通入a mol X和b mol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变.下列说法一定正确的是( )| A. | 平衡时,X的体积分数:M<N | |
| B. | 若向N中再充入a mol X和b mol Y,则平衡时,X的转化率:M<N | |
| C. | 若a:b=1:3,当M中放出172.8 kJ热量时,X的转化率为90% | |
| D. | 若a=1.2,b=1,并且N中达到平衡时体积为2 L,此时含有0.4 mol Z,则再通入0.36 mol X时,v(正)<v(逆) |
分析 A.N中为恒压,M中随反应进行压强减小,反应过程中N中压强大于M中压强,增大压强,平衡向正反应方向移动;
B.向N中再充入a mol X和b mol Y后达到平衡时的状态与未充入X、Y前相同,即互为等效平衡,根据A的分析可知N中转化率较大;
C.反应初始时X的物质的量未知,故转化率未知;
D.若a=1.2,b=1,并且N中达到平衡时体积为2 L,此时含有0.4 mol Z,则:
X(g)+3Y(g)?2Z(g)
开始(mol):1.2 1 0
转化(mol):0.2 0.6 0.4
平衡(mol):1 0.4 0.4
则平衡常数K=$\frac{(\frac{0.4}{2})^{2}}{\frac{1}{2}×(\frac{0.4}{2})^{3}}$=10,反应温度不变,故通入X前后平衡常数不变,未再通入X前,平衡时气体总物质的量为1.8 mol,通入0.36 mol X后,由体积比与物质的量比成正比可知:$\frac{1.8}{2.16}$=$\frac{2}{V}$,解得通入X后的体积V=2.4 L,再计算浓度商,与平衡常数比较判断反应进行方向,可以确定通入0.36 mol X时v(正)、v(逆)相对大小.
解答 解:A.N中为恒压,M中随反应进行压强减小,反应过程中N中压强大于M中压强,增大压强,平衡向正反应方向移动,故平衡时,X的体积分数:M>N,故A错误;
B.向N中再充入a mol X和b mol Y后达到平衡时的状态与未充入X、Y前相同,即互为等效平衡,根据A的分析可知,平衡时X的转化率:M<N,故B正确;
C.反应初始时X的物质的量未知,故转化率未知,故C错误;
D.若a=1.2,b=1,并且N中达到平衡时体积为2 L,此时含有0.4 mol Z,则:
X(g)+3Y(g)?2Z(g)
开始(mol):1.2 1 0
转化(mol):0.2 0.6 0.4
平衡(mol):1 0.4 0.4
则平衡常数K=$\frac{(\frac{0.4}{2})^{2}}{\frac{1}{2}×(\frac{0.4}{2})^{3}}$=10,反应温度不变,故通入X前后平衡常数不变,未再通入X前,平衡时气体总物质的量为1.8 mol,通入0.36 mol X后,由体积比与物质的量比成正比可知:$\frac{1.8}{2.16}$=$\frac{2}{V}$,解得通入X后的体积V=2.4 L,浓度商Qc=$\frac{(\frac{0.4}{2.4})^{2}}{\frac{1+0.36}{2.4}×(\frac{0.4}{2.4})^{3}}$=10.59>K=10,故反应应向逆反应方向进行,则通入0.36 mol X时v(正)<v(逆),故D正确,
故选:BD.
点评 本题考查化学平衡的计算、平衡常数应用、等效平衡等,难度中等,D选项为易错点、难点,注意容器的体积发生变化,而学生容易按体积不变解答,需要根据平衡常数判断平衡移动方向.

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案| A. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
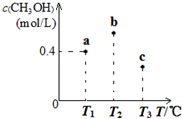
| A. | a容器中,0~5min内平均反应速率ν(H2)=0.04mol/(L.min) | |
| B. | 反应均进行到5min时,三个容器中一定达到化学平衡状态的是b | |
| C. | 当三个容器内的反应都达到化学平衡时,CO转化率最大的是a | |
| D. | 保持温度和容积不变,若开始时向b容器中充入0.6mol CO(g)、1.2mol H2(g)和0.4mol CH3OH(g),则反应开始时ν正(H2)<ν(逆) |
| A. | 氯气能使润湿的淀粉碘化钾试纸变蓝 | |
| B. | 新制的氯水呈黄绿色是因为在溶液中溶有氯气分子 | |
| C. | 与久置氯水不同,在新制氯水中加入硝酸银溶液后无白色沉淀 | |
| D. | 氯水久置后,会使溶液酸性增强 |
| A. | Na与氧气 | B. | 澄清石灰水与二氧化碳 | ||
| C. | 碳与氧气 | D. | 过氧化钠和水 |
| A. | 可燃性气体的验纯 | B. | 滴管不能交叉使用 | ||
| C. | 容量瓶在使用前进行检漏 | D. | 实验剩余的药品不能放回原试剂瓶 |

 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示: