题目内容
14.依据实验数据,写出下列反应的热化学方程式:(1)1molC2H4(g)与适量的O2(g)反应,生成CO2(g)和2O(l),放出1411kJ热量.C2H4(g)+3O2(g)═2CO2 (g)+2H2O(l)△H=-1411 kJ•mol-1
(2)1molN2(g)与适量的O2(g)反应生成NO2(g),吸收68kJ热量.N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1
(3)2molAl(s)与适量的O2(g)反应生成Al2O3(g)放出1669.8kJ热量.2Al(s)+$\frac{3}{2}$O2(g)═Al2O3 (s)△H=-1669.8kJ•mol-1
(4)1molCu(s)与适量的O2(g)反应生成CuO(s),放出157kJ热量.Cu(s)+$\frac{1}{2}$O2(g)=CuO(s△H=-157kJ/mol
(5)1molN2H4(l)与适量的O2(g)反应,生成N2(g)和H2O(l),放出622kJ热量N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol.
分析 热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,根据热化学方程式的书写方法来回答.
解答 解:(1)1mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411kJ热量,即C2H4(g)+3O2(g)═2CO2 (g)+2H2O(l)△H=-1411 kJ•mol-1
,故答案为:C2H4(g)+3O2(g)═2CO2 (g)+2H2O(l)△H=-1411 kJ•mol-1;
(2)1mol N2 (g)与适量O2(g)起反应,生成NO(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1;
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8kJ热量,则2Al(s)+$\frac{3}{2}$O2(g)═Al2O3 (s)△H=-1669.8kJ•mol-1,
故答案为:2Al(s)+$\frac{3}{2}$O2(g)═Al2O3 (s)△H=-1669.8kJ•mol-1;
(4)放热时焓变值为负值,1mol Cu(s)与适量O2(g)起反应,生成CuO(s),放出157kJ热量的热化学方程式为:Cu(s)+$\frac{1}{2}$O2(g)=CuO(s△H=-157kJ/mol,
故答案为:Cu(s)+$\frac{1}{2}$O2(g)=CuO(s△H=-157kJ/mol;
(5)1molN2H4(l)与适量的O2(g)反应,生成N2(g)和H2O(l),放出622kJ热量,热化学方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol,
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | 过滤 | B. | 加入CuSO4溶液 | C. | 加入饱和食盐水 | D. | 分液 |
| A. | 气体单质中,一定有δ键,可能有π键 | |
| B. | δ键比π键重叠程度大,形成的共价键强 | |
| C. | 两个原子间形成共价键时,最多有一个δ键 | |
| D. | N2分子有一个δ键,两个π键 |
| A. | KCl | B. | NaOH | C. | HCl | D. | O2 |
①将胆矾加热变为白色粉末 ②浓硫酸稀释 ③高锰酸钾分解制氧气 ④生石灰跟水反应生成熟石灰.
| A. | ①④ | B. | ①②③④ | C. | ①③ | D. | ②④ |
| A. | AgBr见光会分解,可用于制感光材料 | |
| B. | 碳酸氢钠受热会分解,可用作糕点发酵粉 | |
| C. | 因氯气有毒,不能用于对自来水消毒杀菌 | |
| D. | 由于钝化,浓硫酸可用铝槽车运输 |
| A. | 已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
| A. | 在水中溶解性:Na2CO3<NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 相同条件下与酸反应的快慢Na2CO3<NaHCO3 | |
| D. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
| A. | 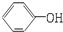 与 与 互为同系物 互为同系物 | B. | 乙醇和乙醚互为同分异构体 | ||
| C. | 乙醇、乙二醇、丙三醇互为同系物 | D. | 分子式为C4H8的烃可能为饱和烃 |