题目内容
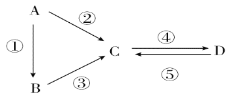
【题目】芳香族化合物X和Y都是从樟脑科植物中提取的香料。X可按如图路线合成Y。

已知:①RCH-CHR’![]() RCHO+R’CHO
RCHO+R’CHO
②不含α-氢原子(与醛基直接相连的碳上的氢)的醛在浓碱作用下醛分子自身同时发生氧化与还原反应,生成相应的羧酸(在碱溶液中生成羧酸盐)和醇的反应。
如:2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
(1)X的官能团名称为___________。
(2)Y的结构简式为___________。
(3)D+G→Y的有机反应类型为___________。
(4)下列物质不能与D反应的是___________(选填序号)
a.金属钠 b.氢溴酸 c.碳酸钠溶液 d.乙酸
(5)写出下列反应方程式:X→G的第①步反应_____________________________。E→F___________________________________。
(6)G有多种同分异构体,写出同时满足下列条件的G的所有同分异构体的结构简式______________(不考虑空间立体异构)。
i.能发生银镜反应 ⅱ.能发生水解反应 ⅲ.苯环上只有一个取代基
(7)G的另一种同分异构体H的结构简式为![]() 下,写出以
下,写出以![]() 为有机原料,制取H的合成路线(可任选无机原料)
为有机原料,制取H的合成路线(可任选无机原料) ![]() →___________。
→___________。
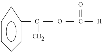
【答案】碳碳双键醛基 ![]() 酯化反应(取代反应) c
酯化反应(取代反应) c ![]()
![]()
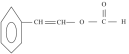
【解析】
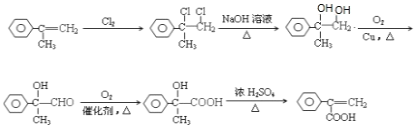
X为芳香族化合物,即X中含有苯环,依据信息①以及A的结构简式,推出A为OHC-CHO,根据信息②,推出E为HOCH2COOH,F为聚合物,E生成F发生缩聚反应,即F的结构简式为![]() ,根据信息②以及C的分子式,推出C为苯甲酸,D为苯甲醇,B为苯甲醛,则X的结构简式为
,根据信息②以及C的分子式,推出C为苯甲酸,D为苯甲醇,B为苯甲醛,则X的结构简式为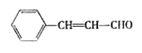 ,X→G发生氧化反应,醛基被氧化成羧基,即G的结构简式为
,X→G发生氧化反应,醛基被氧化成羧基,即G的结构简式为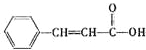 ,D和G发生酯化反应生成Y,其结构简式为
,D和G发生酯化反应生成Y,其结构简式为![]() ;
;
X为芳香族化合物,即X中含有苯环,依据信息①以及A的结构简式,推出A为OHC-CHO,根据信息②,推出E为HOCH2COOH,F为聚合物,E生成F发生缩聚反应,即F的结构简式为![]() ,根据信息②以及C的分子式,推出C为苯甲酸,D为苯甲醇,B为苯甲醛,则X的结构简式为
,根据信息②以及C的分子式,推出C为苯甲酸,D为苯甲醇,B为苯甲醛,则X的结构简式为 ,X→G发生氧化反应,醛基被氧化成羧基,即G的结构简式为
,X→G发生氧化反应,醛基被氧化成羧基,即G的结构简式为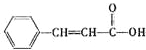 ,D和G发生酯化反应生成Y,其结构简式为
,D和G发生酯化反应生成Y,其结构简式为![]() ;
;
(1)根据上述分析,X的官能团是醛基和碳碳双键;
(2)根据上述分析,推出Y的结构简式为![]() ;
;
(3)D+G→Y的反应类型为取代反应或酯化反应;
(4)D为苯甲醇,a、D中含有-OH,能与金属钠反应,故a不符合题意;
b、D中含有-OH,能与HBr发生取代反应,-Br取代-OH位置,故b不符合题意;
c、苯甲醇不与碳酸钠发生反应,故c符合题意;
d、苯甲醇与乙酸发生酯化反应,故d不符合题意;
(5)X→G的第①步反应发生氧化反应,其反应方程式为:![]() ;
;
E→F发生缩聚反应,其反应方程式为:![]() ;
;
(6)i能发生银镜反应,说明含有醛基,ii能发生水解反应,说明含有酯基,iii苯环上只有一个取代基,符合条件的同分异构体应是甲酸某酯的结构,即结构简式为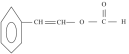 、
、 ;
;
(7)根据所给原料以及产物,发生的一系列反应类型为加成、消去、氧化、消去,合成路线为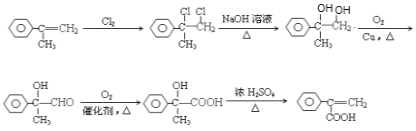 。
。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论或解释 |
A | 向盛有漂白粉溶液的试管中加入浓硫酸 | 产生黄绿色气体 | 浓硫酸具有氧化性 |
B | 向SO2 水溶液中滴入几滴BaCl2溶液,振荡 | 出现白色沉淀 | 此沉淀是BaSO3 |
C | 使装有NO2 气体的密闭容器减小体积 | 气体颜色先变深而后变浅 | 气体颜色变浅的原因是2NO2 =N2O4 正向移动 |
D | 先向2mL0.1mol/LNa2S 溶液中滴入几滴0.1mol/LZnSO4 溶液,再加入几滴CuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | 溶度积Ksp:ZnS>CuS |
A. A B. B C. C D. D
【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:

已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要______(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是____________(用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________。
(4)步骤III中加入Zn粉的作用是:①__________________;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为____________。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
①取1.000g活性氧化锌,用15.00mL 1.000mol·L-1硫酸溶液完全溶解,滴入几滴甲基橙。②用浓度为0.5000mol·L-1的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的依据是_________;所得活性氧化锌的纯度为_________。