题目内容
17.日常生活中会接触到许多化学物质,如牙膏、洁厕灵、“84”消毒液、漂白粉等等.(1)如表列出了三种牙膏中的摩擦剂.请在表中填写三种摩擦剂所属的物质类别(指酸、碱、盐、氧化物)
| 儿童牙膏 | 防臭牙膏 | 透明牙膏 | |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 氧化硅 |
| 物质类别 | 碱 | 盐 | 氧化物 |
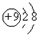 ,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.
,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.(3)“84”消毒液的主要成分是次氯酸钠(NaClO),洁厕灵的主要成分是盐酸(HCl).据网络报道:“84”消毒液+洁厕灵→夺命毒气+水+氯化钠,因此在使用时应避免将两种物质混合.试写出“84”消毒液和洁厕灵混合时产生夺命毒气的化学方程式:NaClO+2HCl=NaCl+Cl2↑+H2O.
(4)使用漂白粉溶液除去白色衣物上的色斑,往往需要将衣物浸泡在其中且露置在空气中30分钟,再进行洗涤效果更好,用化学方程式表示其使用原理Ca(ClO)2+CO2+H2O=CaCO3+2HClO.
分析 (1)根据酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;盐是由金属离子(或铵根离子)和酸根离子组成的化合物;氧化物是指有两种元素组成且一种是氧元素的化合物;
(2)氟原子是9号元素,原子最外层 电子数为7;氟化钠是强碱弱酸盐溶液中完全电离;
(3)“84”消毒液和洁厕灵混合时是次氯酸钠和盐酸发生氧化还原反应生成有毒气体氯气;
(4)漂白粉中的有效成分为次氯酸钙,和空气中二氧化碳、水反应生成次氯酸和碳酸钙,次氯酸具有漂白性.
解答 解:(1)氢氧化铝是由铝离子和氢氧根离子组成的化合物,属于碱;碳酸钙是由钙离子和碳酸根离子组成的化合物,属于盐;二氧化硅是由两种元素组成的且有一种是氧元素的化合物,属于氧化物,
故答案为:碱;盐;氧化物;
(2)氟原子是9号元素,原子最外层 电子数为7,原子结构示意图为 ;氟化钠是强碱弱酸盐溶液中完全电离,电离的方程式为:NaF=Na++F-,
;氟化钠是强碱弱酸盐溶液中完全电离,电离的方程式为:NaF=Na++F-,
故答案为: ;NaF=Na++F-;
;NaF=Na++F-;
(3)“84”消毒液和洁厕灵混合时是次氯酸钠和盐酸发生氧化还原反应生成有毒气体氯气,反应的化学方程式为:NaClO+2HCl=NaCl+Cl2↑+H2O,
故答案为:NaClO+2HCl=NaCl+Cl2↑+H2O;
(4)漂白粉中的有效成分为次氯酸钙,和空气中二氧化碳、水反应生成次氯酸和碳酸钙,次氯酸具有漂白性,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO.
点评 本题考查了物质性质的理解应用,主要是化学方程式书写和产物判断,掌握基础是关键,题目较简单.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
5.下列物质中,存在着氯离子的是( )
| A. | 氯酸钾溶液 | B. | 次氯酸钠溶液 | C. | 液氯 | D. | 氯水 |
12.已知硫酸溶液的质量分数越大时,其溶液的密度越大且密度都大于1g/ml,现将90%和10%的两种H2SO4溶液等体积混合后,溶液的质量分数为( )
| A. | 大于50% | B. | 等于50% | C. | 小于50% | D. | 无法确定 |
2.可逆反应A(g)+B(g)?C(g)+D(g).在一定条件下,说明该反应已达到平衡状态的是( )
| A. | 容器内压强不随时间变化 | B. | A、B、C、D四者共存 | ||
| C. | 消耗A的速率与生成A的速率相等 | D. | D、C的生成速率相等 |
9.已知热化学方程式2C2H2(g)+5O2g)=4CO2(g)+2H2O(g)△H=-1256kJ/mol,下列说法正确的是( )
| A. | 乙炔的燃烧热为1256 kJ/mol | |
| B. | 若转移10 mol电子,则消耗2.5 mol O2 | |
| C. | 若生成2 mol 液态水,则△H=-1256 kJ/mol | |
| D. | 若形成4 mol碳氧共用电子对,则放出的热量为1256 kJ |
6.如表是A、B二种有机物的有关信息;
根据表中信息回答下列问题:
(1)A与含溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式nCH2═CH2$\stackrel{催化剂}{→}$ .
.
(2)A与氢气发生加成反应后生成C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是①②③(填序号):
①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$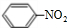 +H2O.
+H2O.
| A | B |
| ①能使含溴的四氯化碳溶液褪色; ②比例模型为: 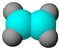 ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为:  |
(1)A与含溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式nCH2═CH2$\stackrel{催化剂}{→}$
 .
.(2)A与氢气发生加成反应后生成C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是①②③(填序号):
①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$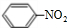 +H2O.
+H2O. 
 .
.