题目内容
【题目】硅铁合金广泛应用于冶金工业,可用于铸铁时的脱氧剂、添加剂等,回答下列问题:
(1)基态Fe原子价层电子的电子排布图为________,基态Si原子电子占据最高能级的电子云轮廓图为________形。
(2)绿帘石的组成为![]() ,将其改写成氧化物的形式为_____________.
,将其改写成氧化物的形式为_____________.
(3)![]() 分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
|
|
|
| |
熔点/K | 182.8 | 202.7 | 278.5 | 393.6 |
沸点/K | 177.4 | 330.1 | 408 | 460.6 |
(4)![]() 可与乙二胺(
可与乙二胺(![]() ,简写为en)发生如下反应:
,简写为en)发生如下反应:![]()
![]() 。
。![]() 的中心离子的配位数为________;
的中心离子的配位数为________;![]() 中的配位原子为________。
中的配位原子为________。
(5)在硅酸盐中,![]() 四面体(图
四面体(图
|
|
图a | 图b |
【答案】![]() 哑铃 4CaOFe2O32Al2O36SiO2H2O 4 正四面体形 熔、沸点依次升高,原因是分子结构相似,相对分子量依次增大,分子间作用力逐渐增强 6 O和N sp3
哑铃 4CaOFe2O32Al2O36SiO2H2O 4 正四面体形 熔、沸点依次升高,原因是分子结构相似,相对分子量依次增大,分子间作用力逐渐增强 6 O和N sp3 ![]() 或Si2O52-
或Si2O52-
【解析】
(1)基态Fe原子价层电子为其3d、4s能级上电子;基态Si原子电子占据的能级有1s、2s、2p,最高能级为2p;
(2)绿帘石的组成为Ca2FeAl2(SiO4) (Si2O7)O(OH),将其改写成氧化物的形式时应结合元素的化合价,依次写出金属氧化物、非金属氧化物、最后是水,并注意原子的最简单整数比不变;
(3)SiCl4分子的中心原子为Si,形成4个σ键,具有甲烷的结构特点;由表中数据可知四卤化硅的沸点逐渐升高,为分子晶体,沸点与相对分子质量有关;
(4)配离子为[Fe(H2O)6]2+,中心离子为Fe3+,配体为H2O,[Fe(H2O)4(en)]2+中配体为H2O和en,根据孤对电子确定配位原子;
(5)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;图中为一种无限长层状结构的多硅酸根,图中一个SiO44-四面体结构单元中其中有3个氧原子的贡献率为![]() 。
。
(1)基态Fe原子的核外价电子排布式为[Ar]3d64S2,基态Fe原子价层电子为其3d、4s能级上电子,则基态Fe原子的核外价电子排布图为![]() ;基态Si原子电子占据的能级有1s、2s、2p,最高能级为2p,其电子云轮廓图为哑铃形;
;基态Si原子电子占据的能级有1s、2s、2p,最高能级为2p,其电子云轮廓图为哑铃形;
(2)绿帘石的组成为Ca2FeAl2(SiO4) (Si2O7)O(OH),将其改写成氧化物的形式为4CaOFe2O32Al2O36SiO2H2O;
(3)SiCl4分子的中心原子为Si,形成4个σ键,价层电子对数为4,具有正四面体结构;四卤化硅的沸点逐渐升高,为分子晶体,沸点与相对分子质量有关,相对分子质量越大,沸点越高;
(4)配离子为[Fe(H2O)6]2+,中心离子为Fe3+,配体为H2O,则配位数为6;![]() 中配体为H2O和en,其中O和N原子均能提供孤对电子,则配位原子为O和N;
中配体为H2O和en,其中O和N原子均能提供孤对电子,则配位原子为O和N;
(5)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;图(b)为一种无限长层状结构的多硅酸根,图(a)中一个SiO44-四面体结构单元中其中有3个氧原子的贡献率为![]() ,SiO44-四面体结构单元含有1个硅、氧原子数目=1+3×
,SiO44-四面体结构单元含有1个硅、氧原子数目=1+3×![]() =2.5,Si、O原子数目之比为1:2.5=2:5,故化学式
=2.5,Si、O原子数目之比为1:2.5=2:5,故化学式![]() 或Si2O52-。
或Si2O52-。

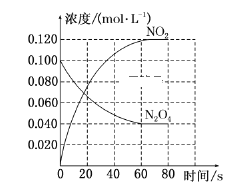
【题目】三氯胺(![]() )是一种饮用水二级消毒剂,可由以下反应制备:Ⅰ.
)是一种饮用水二级消毒剂,可由以下反应制备:Ⅰ.![]()
![]() 。回答下列问题:
。回答下列问题:
(1)已知:Ⅱ.![]()
![]() Ⅲ.
Ⅲ.![]()
![]() ,则
,则![]() ________(用含
________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2 L的甲、乙两个恒温密闭容器中分别加入![]() 和
和![]() ,发生反应Ⅰ,测得两容器中
,发生反应Ⅰ,测得两容器中![]() 随反应时间的变化情况如下表所示:
随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲( | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙( | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80 min内,容器甲中![]() ________。
________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于反应Ⅰ,下列说法正确的是________(填选项字母)。
a.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
b.容器内气体密度不变,说明反应达到平衡状态
c.达平衡后,加人一定量![]() ,平衡逆向移动
,平衡逆向移动
d.达平衡后,按原投料比再充入一定量反应物,平衡后![]() 的转化率增大
的转化率增大
④温度为![]() 时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2 L的可变容器,平衡时容器中
时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2 L的可变容器,平衡时容器中![]() ________(填“>”“=”或“<”)1.6 mol。
________(填“>”“=”或“<”)1.6 mol。
⑤温度为![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ________。
________。